|
||||
 |
||||
|
||||
|
||||
Para su presentación los agrupamos en factores clínicos, genéticos y hereditarios, hormonales, ambientales, otras enfermedades mamarias predisponentes, la raza, y otros cuyo papel no está esclarecido (lactancia materna, traumatismos y otras enfermedades del organismo).
Es importante averiguar determinados aspectos de la vida de la paciente por si suponen factor de riesgo: edad, sexo, datos de filiación, profesión-ocupación, historial ginecológico y endocrino, datos de su vida de relación sexual, uso de fármacos (anovulatorios...), estado físico y general, hábito constitucional (obesidad)... Varios factores de riesgo que se asocian a la presentación de cáncer de mama, en primer lugar son el sexo femenino y la edad. A continuación se señalan los factores de riesgo más relevantes. Sin embargo, es importante señalar que la mayoría de las mujeres con cáncer de mama no tienen factores de riesgo identificables.
5.1 Historia familiar y herencia Las mujeres que tienen familiares en primer grado diagnosticadas de cáncer de mama tienen tres veces más posibilidades de padecer el mismo cáncer, sobre todo en los casos en los que se ha diagnosticado en edad premenopáusica. La presencia de cáncer de mama en familiares de 2º grado también aumenta el riesgo pero no ha sido cuantificado, (madre, hija, hermana, tía carnal...), El riesgo de una mujer de desarrollar cáncer de mama es mayor si su madre, hermana o hija, tuvo CM, sobre todo a una edad joven (antes de los 40 años). En un 20-25% de los casos tienen cierta asociación familiar (algún caso de CM en la 1ª o 2ª generación familiar), y un 5-10% tiene un componente hereditario (subgrupo de CM familiar, que además tiene mayor penetrancia de afectación familiar, afectación muy temprana con focos múltiples y asociación a otros tipos de cáncer como colon o endometrio u otras lesiones que forman parte del síndrome de Lynch III). Un amplio abanico de situaciones de herencia se acompaña de un riesgo elevado de aparición de CM. Los más importantes son los BRCA1 y BRCA2. Las mutaciones de estos genes están en el origen del 2-3% casos de CM y en más de la mitad de los hereditarios; significa un riesgo del 50-85% de padecer cáncer de mama y un 10-45 Otros casos de CM familiar se asocian en los síndromes de Li-Fraumeni, Muir-Torre, Cowden y Peutz-Jeghers % de cáncer de ovario a lo largo de la vida Como ya se ha comentado anteriormente, los cambios en ciertos genes (BRCA1, BRCA2 y otros que a continuación se citarán) aumentan el riesgo de cáncer de mama. En las familias en las que muchas mujeres han tenido la enfermedad, la prueba genética puede mostrar algunas veces la presencia de cambios genéticos específicos. Los proveedores de cuidados para la salud pueden sugerir formas para tratar de reducir el riesgo de cáncer de seno o mejorar la detección de esta enfermedad en mujeres que tienen estos cambios en sus genes. Las primeras evidencias de que existía un gen dominante de la susceptibilidad al cáncer de mama surgieron en 1984 mediante un modelo estadístico utilizado por Williams y Anderson a partir del estudio de 200 familias. Este primer estudio, junto a otros posteriores, pusieron en evidencia que las mutaciones en el gen BRCA1 daban lugar a la aparición de síndrome de cáncer de mama y ovario en el 90% de los casos (el 45% sólo de mama) Posteriormente, se localizó otro gen relacionado con esta susceptibilidad que se identificó como BRCA2. Los estudios del gen BRCA2 han puesto en evidencia que es el responsable del 35% de los cánceres de mama hereditarios en mujeres y de un 14% del cáncer de mama en varones. Los primeros estudios epidemiológicos llegaron a atribuir el 90% de los casos de cáncer de mama hereditario a los genes BRCA, mientras que estudios recientes cifran esta prevalencia entre el 45 y el 68%.Se han descrito alrededor de 600 mutaciones distintas en el gen BRCA1 y más del 75% dan origen a una proteína truncada, incrementando el riesgo del desarrollo del cáncer de mama entre los 40 y 50 años, el cáncer de ovario, el cáncer de próstata y el cáncer de colon.
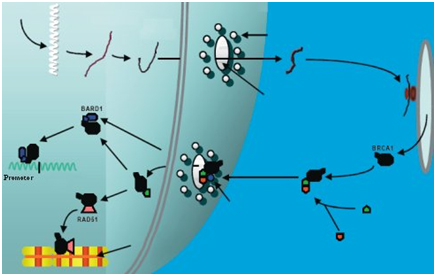
Este gen se halla ubicado en el brazo largo del cromosoma 17 (17q21) y codifica para una proteína encargada de regular el proceso de reparación del ADN.La proteína BRCA1 interviene en las fases S y G2 del ciclo celular. Cuando se produce un daño en el ADN, la proteína BRCA1 se hiperfosforila y se relocaliza en los sitios de síntesis de ADN, formando un complejo con otras proteínas como la BRCA2 y la Rad51, encargadas de reparar el daño al ADN asociado a la replicación. El gen BRCA1 parece que regula los genes para encontrar y reconocer el daño del ADN y se cree que induce la expresión de genes reparadores que trabajan para reducir el daño y ayudar a la replicación del ADN. Por otro lado, este gen se expresa en las células de los distintos epitelios del organismo durante el desarrollo. Su expresión se ve aumentada durante el embarazo y diminuye tras el parto. Se ha observado que BRCA1 es inducido por estrógenos. La inhibición de este gen, causa un aumento de la proliferación de células del epitelio mamario.
La expresión normal del gen BRCA1 se ha demostrado en ratas de experimentación que puede inhibir el crecimiento de células tumorales de mama y ovario, mientras que una deleción de los 10 últimos aminoácidos de BRCA1 es suficiente para abolir esta capacidad inhibidora tumoral.
Un gran número de tumores de mama y ovario de las pacientes portadoras de mutaciones presentan la pérdida de la copia normal del BRCA1, quedando sólo la forma que contiene la mutación heredada. Esto es lo que se denomina pérdida de la heterocigosidad (LHO). Respecto al gen BRCA2, se han descrito unas 450 mutaciones y, al igual que las mutaciones del BRCA1, muchas son de significado incierto. Las mutaciones de BRCA2 se hallan asociadas a un riesgo incrementado para el desarrollo de diversos cánceres, como el de mama femenino y masculino, el de ovario, de próstata, de páncreas y de laringe. BRCA2 se halla ubicado en el brazo largo del cromosoma 13 (13q 12-13). Al igual que BRCA1, el producto génico de BRCA2 está involucrado en el proceso de reparación del ADN, formando un complejo multiproteico con otras proteínas como la Rad. 51, BARD1 y BRCA1. Por otro lado, parece que existe una relación sinérgica de BRCA2 con el gen p53. El gen p53, al igual que BRCA1 y BRCA2, es un gen supresor de tumores, pero, a diferencia de los dos primeros, se encuentra mutado en la mitad de los casos de cáncer en general. Los criterios para realizar el análisis de los genes BRCA son los siguientes:
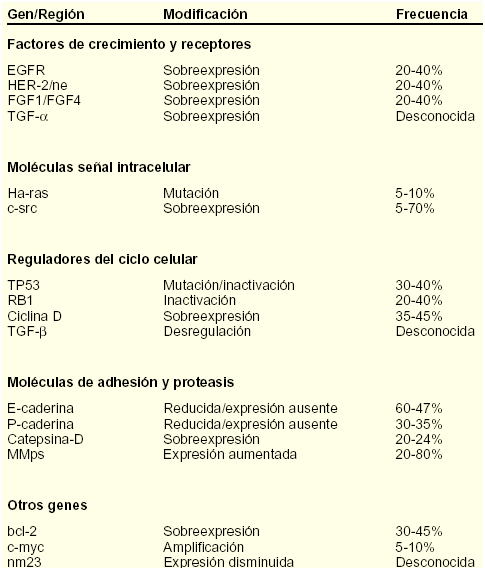
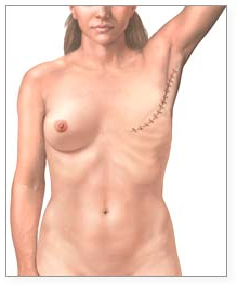
Por lo tanto, el carácter hereditario de un cáncer de mama no puede ser excluido definitivamente, aunque el test de los BRCA no dé positivo, ya que podrían existir otras mutaciones en estos mismos genes que no se han identificado, o mutaciones en otros genes de susceptibilidad que son, todavía hoy, desconocidos. En el Carcinoma in situ a parte de la proliferación celular, que ha demostrado su eficacia como parámetro pronóstico, numerosos grupos están centrando su atención en el estudio de ciertas moléculas de la matriz extracelular relacionadas con la adhesión, ya que pueden aportar esa información que desea el médico. Así, la expresión tenascina estromal se correlaciona significativamente con el grado nuclear, histológico y mitosis, y su localización periductal se asocia con una mayor probabilidad de invasión, y es un factor pronóstico independiente; la de la conexina 43 falta frecuente en los carcinomas in situ, y es un marcador precoz de transformación y la de la gelsolina, proteína fijadora de la actina, está disminuida en el 70% de los carcinomas esporádicos. Otras sustancias (actina específica muscular [MSA]) pueden usarse en el diagnóstico diferencial entre carcinoma in situ e hiperplasia ductal atípica, reflejar la invasión estromal (colágenos I y III) o el paso de carcinoma in situ a invasivo (factor cripto). Por otro lado, se ha demostrado que en el carcinoma invasivo además de ciertos genes empleados de forma rutinaria (p53 o Erbb2) está prevaleciendo, como ya hemos citado anteriormente, el estudio y uso de sustancias relacionadas con la adhesión y matriz extracelular que son el exponente de las primeras fases invasivas del tumor (anclaje celular y degradación de la matriz extracelular). Así, la positividad de la tenascina en los bordes invasivos de los tumores sin adenopatías y tratados con cirugía conservadora y radioterapia, es un factor pronóstico de recidivas locales; la pérdida de laminina 5 es un episodio precoz de malignidad e invasión y la ausencia de caderina 11 indica diseminación, y además, junto con el tumor supresor nm23 y la angiogénesis, demostró ser un factor pronóstico en los casos sin ganglios axilares (García V. et al, 2001, 145) , superando al grado histológico y al tamaño. Conviene recordar que ciertas moléculas de adhesión (N-caderina, mesenquimal, integrinas alfa-1, alfa-2 y alfa-3) se asocian con una mayor capacidad invasiva, al promover la motilidad, la invasión y las metástasis, y al potenciar, así mismo, la producción de ciertas proteasas (MMP9, estromalisina 1 [MMP9]), lo que resulta de gran importancia fisiopatológica. Recientemente, se ha destacado el interés de la osteopontina y la sialoproteína ósea. Aquélla es una glucoproteína secretada con una región RGD, lo que le permite interrelacionarse con la matriz extracelular. Se expresa en el 77% de los carcinomas mamarios in situ e invasivos, lo que conlleva una mayor capacidad infiltrativa y la expresión del activador del plasminógeno tipo urocinasa, proteasa asociada con peor comportamiento. La presencia de osteopontina o sialoproteína ósea en la célula tumoral le confiere una mayor capacidad de supervivencia, gracias a su unión a la integrina v3 (ambas) o CD44 (osteopontina) en la membrana celular, seguida del secuestro del factor H y de la inhibición de la lisis celular mediada por el complemento(Workman L., 2003, 23). La expresión tisular de sialoproteína ósea también es un factor predictor muy importante de la capacidad metastásica ósea y lo mismo ocurre cuando se incrementa en el suero, donde empieza a ser dosificada Fig.4. Mujer adulta tras una mastectomía. Se han estudiado en los tumores de mama numerosas enzimas degradantes de la matriz extracelular, ya sea de forma aislada o con sus receptores e inhibidores. De todas las descritas, sólo el sistema del activador del plasminógeno, especialmente el tipo urocinasa y sus inhibidores, no ha sido cuestionado y sigue conservando su valor pronóstico desde las primeras descripciones, por lo que su uso puede estar justificado. Sin embargo, conviene recordar que el efecto biológico final de una proteasa, cuyo origen puede ser el tumor o la estroma vecina, depende de su concentración, de la de su/sus inhibidores y de sus receptores, y que no siempre mayor concentración de proteasa es sinónimo de mal pronóstico (Ruibal A., 2001, 433-435) Mención especial con respecto al c-erb B2 determinado mediante inmunohistoquímica no es un factor independiente de pronóstico en carcinomas ductales infiltrantes de mama T2N1. Los receptores estrogénicos presentan una relación inversa con c-erb B2 con significación estadística. (p = 0,0403).
5.3 Factores hormonales y endocrinos.
Es reseñable el hecho de que Desde hace muchos años sabemos que el contexto hormonal de la feminidad favorece la formación del CM. El mecanismo íntimo no se conoce a ciencia cierta, aunque el estimulo favorecedor de la proliferación y división celular que ejercen las hormonas femeninas sobre el tejido funcional mamario está involucrado; en concreto los estrógenos cuando se encuentran en situación o concentración descompensada sobre los progestágenos, producen un contexto favorable para la proliferación celular.
Todas las situaciones que suponen mayor exposición a picos de estrógenos, son factores de riesgo reconocidos:
El pronóstico no es significativamente diferente del cáncer de mama no asociado a la gestación, excepto en los casos en que el retraso en el diagnóstico se asocia con estadios más avanzados. Cierta mención merece el haber tomado dietilestilbestrol (DES): El dietilestilbestrol es una forma sintética de estrógeno que se dio a algunas mujeres embarazadas en Estados Unidos entre 1940 y 1971 más o menos. (El DES ya no se da a mujeres embarazadas). Las mujeres que tomaron DES durante el embarazo tienen un riesgo ligeramente mayor de CM. No parece todavía que este sea el caso en cuanto a sus hijas que estuvieron expuestas al dietilestilbestrol antes de nacer.
Es posible que una parte importante de las observaciones de diferencia de incidencia entre diversas regiones del mundo se explique por factores ambientales. El CM es más frecuente en pacientes de clase social alta, más frecuente en zonas urbanas que rurales y en cuanto a aspectos geográficos, algunos se involucran con el contexto del ritmo de vida del mundo occidental.
Las radiaciones ionizantes se acompañan con riesgo elevado a partir de 20-30 años después de la exposición. La exposición a determinados carcinógenos ambientales limitados en zonas geográficas como algunos pesticidas (especialmente los organoclorados) se comportan con efecto estrogénico (disruptores endocrinos).
Se ha discutido si las dietas ricas en grasas aumentan el riesgo de CM pero no sabemos la causa última (¿en parte por lo que supone de carencia de vitaminas A, C y E?). Otros aspectos estudiados como la cafeína, el tabaco y otros diversos no se conoce a ciencia cierta si influyen...Al parecer, según recientes estudios, un consumo abusivo de alcohol (3-4 vasos por día) parece que aumenta las concentraciones plasmáticas de estrógenos, pudiendo conferir un pequeño aumento del riesgo de presentar este tipo de cáncer.
5.5 Radioterapia
Las mujeres que han recibido radioterapia en el área torácica (incluyendo las mamas) antes de los 30 años tienen un riesgo mayor de cáncer de mama. Esto incluye a mujeres que han recibido tratamiento para linfoma de Hodgkin. Los estudios muestran que cuanto más joven era la mujer cuando recibió el tratamiento de radiación, mayor es el riesgo de que desarrolle CM más tarde en su vida.
5.6 Otras enfermedades de la mama
Después de varios estudios de seguimiento, se sabe que una serie de enfermedades mamarias incrementan el riesgo de CM. Unas tienen riesgo muy elevado (riesgo alto RR 10 o más veces...): haber tenido antecedente personal de CM o de Ca de endometrio. Otras riesgo moderado (RR 4-5 veces...), como la Hiperplasia epitelial atípica. Presentan riesgo leve (RR 1.5-2 veces, adenosis esclerosante, hiperplasia epitelial moderada y los papilomas). En otras enfermedades de la mama, se supone que no hay riesgo aumentado de desarrollar CM: adenosis simple, alteraciones quísticas, metaplasia apocrina, hiperplasia epitelial leve, fibroadenoma pequeño...
Anteriormente se pensaba que la lactancia materna por un periodo superior a 36 meses durante los años fértiles protegía frente al CM. Parece que esto no está claro, y que el efecto protector está más en relación al embarazo... El papel del supuesto factor vírico de BittnerI estudiado en los roedores, hoy no está claramente establecido en el hombre...
Aunque se suponía un papel etiológico, no se ha demostrado... Lo que ocurre es que los traumas producen áreas de necrosis grasa, y estas distorsionan la arquitectura glandular, sobre todo en la mamografía.
5.9 Otros factores que no parecen suponer riesgo de CM
Se ha expuesto que una serie de factores tenían un papel etiológico, que hasta ahora no se ha demostrado. Son medicamentos como el diacepam, reserpina, enfermedad tiroidea, colecistecomía, tintes del pelo, tensión emocional, tabaco...
5.10 Antecedentes personales de cáncer de mama
La mujer que ha tenido cáncer de mama tiene un riesgo mayor de padecer esta enfermedad ya sea ipsilateral si el tratamiento es conservador o contralateral
Algunas mujeres tienen células en la mama que se ven anormales histopatológicamente. El tener ciertos tipos de células anormales (hiperplasia atípica o carcinoma lobulillar in situ (CLIS) aumenta el riesgo de cáncer de mama.
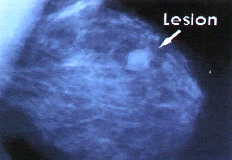
Las mujeres de más edad que tienen más bien tejido denso (no graso) en una mamografía tienen un riesgo mayor de cáncer de mama, pero no se ha demostrado que un mayor volumen mamario aumente el riesgo de CM. Muchos factores de riesgo pueden evitarse. Otros, como los antecedentes familiares, no se pueden evitar. Ayuda estar al tanto de los factores de riesgo. Pero es también importante tener en cuenta que la mayoría de las mujeres que tienen estos factores de riesgo no padecen cáncer de seno. También, la mayoría de las mujeres que desarrollan cáncer de seno no tienen antecedentes de esta enfermedad en su familia. De hecho, con excepción del envejecimiento, la mayoría de las mujeres que tienen cáncer de seno no tienen factores de riesgo acentuados Fig 5. Lesión sospechosa de carcinoma de mama. Sin embargo, la mujer que piensa que pueda tener el riesgo de cáncer de seno deberá discutir su preocupación con su proveedor de servicios para la salud. El proveedor de servicios para la salud puede sugerir formas de reducir el riesgo y puede planear un programa adecuado de exámenes. I: En 1936 cuando J. Bittner tuvo la idea de permitir que ratones recién nacidos descendientes de una cepa caracterizada por una baja incidencia de tumores mamarios fueran amamantados por ratonas adultas pertenecientes a una cepa con alta incidencia de carcinomas mamarios. Las observaciones de Bittner lo llevaron a proponer la existencia de un factor presente en la leche materna capaz de influir la inducción del cáncer mamario. El agente transmitido en la leche de las ratonas adultas no era expresado inmediatamente y los ratones afectados permanecían libres de enfermedad hasta que llegaban a una edad media, a partir de la cual empezaban a desarrollar tumores mamarios. Los resultados de Bittner obligaron a replantear ciertas suposiciones iniciales referentes al origen del cáncer. (Torrades S., 2003, 34)
|
||||
| << Factores predisponentes para el Ca de mama | Referencias iconográficas >> | |||