Por muy pulcros que queramos ser nos es imposible escapar a la suciedad. Por mucho que lo intentemos evitar,la ropa siempre acaba manchada. Nos cae un poco de café, la sopa nos salpica accidentalmente, un bolígrafo nos heche demasiada tinta, o nos apoyamos sobre una barra oxidada. Hay infinitas situaciones de las que nos es imposible escapar sin una "medalla". También hemos de tener en cuenta que las manchas no solo han de ser sólidas o líquidas. El humo de un cigarro impregna rápidamente las fibras de ropa, e incluso el pelo, por no hablar de la contaminación que generan automóviles y fábricas. Y tampoco hay que olvidar que las manchas no tienen por que estar generadas únicamente por factores externos, ya que también puede deberse a nuestro sudor.
Desde luego, el agua no es suficiente para eliminar toda esta suciedad, y desde tiempos inmemoriables el hombre ha recurrido al jabón. No es que en la antiguedad se usara demasiado, pero si que se hacia uso de él, y se fabricaba a partir de cenizas y aceite. Conforme la técnica a evolucionado se han ido fabricando más y mejores productos de lavado, que no solo limpian bien, sino que además acompañan de funciones blanqueantes, o de preservadores del color o de perfumes. Pero aquí nos vamos a ocupar de la función básica. El lavado.
Lo semejante disuelve a lo semejante. Y es primordial entender esta idea primera para poder entender como funciona un jabón o un detergente. En primer lugar hay que decir que el agua es un compuesto polar. Es decir su molécula tiene una separación de carga. En un lado de la molécula tenemos el oxígeno (que tiene una carga parciál negativa) y en el otro lado tenemos los hidrógenos (que tienen una carga parcial positiva). De manera que al igual que una pila tiene dos polos, se podria decir que una molécula de agua tiene dos polos. Las moléculas apolares son aquellas que carecen de separación de cargas. Es decir no tienen polos. Las moleculas polares solo disuelven, o se disuelven en sustancias que sean polares ya que los partes negativas de unas moléculas se sienten atraidas por las partes positivas de otras moléculas, y viceversa, y se crea una atracción electrostática que las mantiene débilmente unidas. Sin embargo las moléculas polares como el agua son incapaces de disolver las moléculas apolares, ya que como estas últimas carecen de carga, no puede haber atracción eléctrica, por lo que las moléculas apolares prefieren quedarse unidas a ellas mismas, o a otras moléculas apolares.
Y el problema viene con que el agua es polar, y la mayoría de las sustancias que manchan son polares. Por lo tanto el agua sola es incapaz de disolver y arrastrar la suciedad. Tampoco podemos utilizar un disolvente apolar, como el diclorometano o el ciclohexano para limpiar. Y no por lo caro que ya pudiera resultar, o por lo contaminante que pudiera resultar, sino que además acabaríamos con toda la ropa estropeada.
La solución es pues utilizar los jabones o los detergentes.
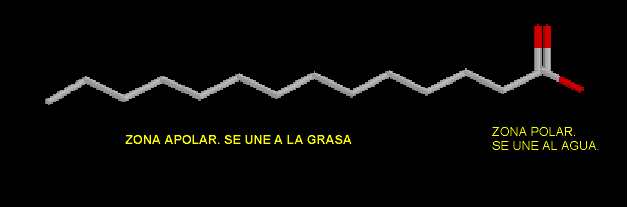
De forma general los jabones son sales sódicas de ácidos grasos. Tienen una cola apolar formada por una larga cadena hidrocarbonada, y una cabeza apolar formada por un grupo ácido esterificado con sodio. De manera que la cabeza polar lo que hace es liberar el ión sodio y prefiere fijarse al agua. La cola apolar se une a la suciedad, y de esta manera es arrastrada. La pega que tienen los jabones es que no son demasiado eficaces en aguas duras, es decir en lugares donde el agua contiene mucho ión calcio e ión magnesio. Estos iones compiten con el agua mucho más duramente que el sodio, por el grupo ester. El agua no puede unirse tan eficazmente a la zona polar y por lo tanto no arrastra al jabón.

Los detergentes en ese aspecto son mejores. El hombreha modificado la zona polar y el grupo estérico ha sido sustituido por grupos fosfónicos y sulfónicos, que apenas tienen apetencia por los iones calcio y magnesio. De esa manera el agua no ha de competir con ellos y puede disolver al detergente que esta vez sí arrastra a la suciedad.
