
FACULTAD DE MEDICINA
UNIVERSIDAD DE VALENCIA
CORAZÓN: DESARROLLO Y CARDIOPATÍAS CONGÉNITAS
ASOCIADAS
MERCEDES JORDÁN DE LUNA
VALENCIA, MAYO 2006
A mi madre, sin la cual hubiese sido imposible la
realización del trabajo.
A todos aquellos que me ayudaron con el complejo
mundo de la informática. Sé que no es fácil
A Nahiko, que me sirvió de conejillo de Indias.
Todavía espero tu opinión sobre la última versión.
Corazón. Febrero 2006. Corazón humano. (en linea). Encarta,
edición online. Disponible en:
http://es.encarta.msn.com/media_461516306_761572608_1_1/Coraz%C3%
B3n_humano.html (figura de portada)
ÍNDICE
1.INTRODUCCIÓN
1.1 Diferenciación celular y gametogénesis
1.2 Fecundación
1.3 De la segmentación a la blástula
1.4 Blástula. Disco germinativo bilaminar
1.5 Gástrula. Disco germinativo trilaminar
2. APARATO CIRCULATORIO. FUNCIONAMIENTO FISIOLÓGICO
2.1Actividad durante la vida fetal
2.2
Cambios en el momento del nacimiento
3. CARDIOPATÍAS CONGÉNITAS
3.1 Defectos congénitos. Alteraciones en la circulación
3.2 Primeros estadios del desarrollo
3.3 Formación y posición del tubo cardíaco
3.4 Formación del asa
cardíaca
3.4.1 Anomalías en la formación del asa cardíaca
3.5 Formación
del seno venoso
3.6 Formación de
los tabiques cardíacos. Anomalías en la formación de los tabiques
cardíacos
3.6.1 Tabicamiento de la aurícula común
3.6.1.1 Anomalías en el tabicamiento de la aurícula común
3.6.2 Tabicamiento del canal auriculoventricular
3.6.2.1 Anomalías en el tabicamiento del canal
auriculoventricular
3.6.3 Tabicamiento del ventrículo común. Desarrollo de
las válvulas cardíacas. División de los tractos descendentes
A)Tabicamiento ventricular
B)Desarrollo de las válvulas cardíacas
C)División de los tractos descendentes
3.6.3.1 Anomalías en
la formación de los tabiques, válvulas cardíacas y división de los
tractos descendentes
4. CONCLUSIONES
5. APÉNDICE BIBLIOGRÁFICO
.
“Natalia se marcha de campamento dentro de una semana. Va con Marta,
su mejor amiga. Es la primera vez que salen de casa y dice que hasta
ahora su madre no la había dejado porque no se había informado y no se
fiaba mucho. Natalia tiene trece años y un problema de corazón desde
que nació, los médicos lo llaman cardiopatía congénita”.
nota 1
Así es como
comienza la historia de Marta, pero podría ser también la de muchos
otros niños. En España 8 de cada mil niños nacen con una cardiopatía
congénita .
nota 2
Pero, ¿Qué es una cardiopatía congénita? “Cardiopatía”, es cualquier
enfermedad o trastorno del corazón. “Congénita” indica que es algo
presente y que existe en el momento del nacimiento. Podríamos decir,
que son aquellas enfermedades que se producen durante el desarrollo
del feto.
Este trabajo pretende recoger, de forma general, cuál es el proceso
por el que se forman y cuáles con las cardiopatías congénitas más
comunes y ayudar de alguna forma al lector menos versado en la materia
1.1
Diferenciación celular y gametogénesis 
Los gametos derivan de las células germinales que se diferencian en el
embrión durante la segunda semana de desarrollo, en una zona del saco
vitelino próxima al pedículo por el que el embrión permanece unido a
la madre. Su número se incrementa por divisiones mitóticas durante la
migración y al llegar a la gónada en formación.
En el caso masculino, las células no experimentarán la maduración
hasta la pubertad momento en que darán lugar a los espermatocitos
primarios los cuales a través de dos divisiones meióticas sucesivas
producen cuatro espermátides. Las espermátides sufren una serie de
cambios (proceso conocido como espermiogénesis) para transformarse así
en espermatozoides.
Por otra parte, la maduración de las células germinales primordiales
femeninas a óvulos maduros comienza antes del nacimiento.
Estas células se diferencian primero a ovogonias. Después de
repetidas divisiones mitóticas, algunas se detienen en la profase de
la meiosis I para formar ovocitos primarios. Alrededor del 7º mes casi
todos se han vuelto atrésicos y quedan unos pocos rodeados por una
capa de células foliculares derivadas de la superficie del epitelio
del ovario. En conjunto forman el folículo primordial.
En la pubertad un grupo de folículos es reclutado y mantenido. Cada
mes madurarán unos cuantos de estos y pasarán por tres estadios
diferentes (folículo primario, secundario y preovulatorio)
El ovocito primario permanece en profase I hasta que el folículo
secundario madura. Es entonces cuando la meiosis I se completa y se
forma un ovocito secundario y un cuerpo polar. A continuación el
ovocito secundario se detiene en metafase II aproximadamente tres
horas antes de la ovulación y no podrá completar la división celular
hasta la fecundación.
1.2 Fecundación 
La expulsión del ovocito se produce gracias a unas contracciones
musculares locales en la pared del ovario. Por la acción de vaivén de
las fimbrias de la trompa de Falopio, el ovocito es conducido hacia el
interior de la trompa uterina y allí es impulsado mediante cilios.
Será fecundado, por lo general, en el tercio distal de la trompa.
El espermatozoide deberá haber experimentado una serie de reacciones
(capacitación y reacción acrosómica) para poder fecundar al ovocito.
1.3 De la segmentación a la blástula 
El pronúcleo masculino y femenino se unen y replican su ADN. Los
cromosomas se disponen en el huso, y se preparan para iniciar la
mitosis. Este es el período bicelular.
A continuación el cigoto experimenta una serie de divisiones
mitóticas, cada una de las nuevas células que se forman se denominan
blastómeras.
Cuando el cigoto está formado por 16 de estas blastómeras, se
encuentra en la fase de mórula. Se produce al tercer día.
Por la compactación tiene lugar la división de las células en dos
grupos: uno de células internas (o macizo celular interno) y otro de
células externas (o macizo celular externo). Las primeras darán lugar
al embrioblasto, mientras que las segundas darán lugar al trofoblasto
que formará los anexos del embrión.
En el momento en que la mórula entra en la cavidad del útero, comienza
a introducirse líquido que se expande entre los espacios
intercelulares de la masa celular interna. Poco a poco los espacios
intercelulares confluyen formando una cavidad que se conoce como
blastocele.
1.4 Blástula. Disco germinativo bilaminar 
A partir del 8º día el embrioblasto comienza a sufrir cambios
espectaculares que darán lugar finalmente a la morfología
humana. nota 3
En el desarrollo del embrión pueden darse diferentes anomalías que
supongan patologías, y, en los casos más graves, conduzcan a la
muerte del feto.
- Día 8
El embrioblasto se diferencia en dos capas: el epiblasto (superior) y
el hipoblasto (inferior). Es entonces cuando queda establecido el
disco embrionario bilaminar.
- Día 9
El íquido continua nutriendo a la célula. Entre las células del
epiblasto aparecerá una pequeña cavidad que después se agranda, es la
vesícula amniótica primitiva.
Por la otra parte, un conjunto de células rodearán al hipoblasto
formando el revestimiento de la cavidad exocelómica o saco vitelino
primitivo.
- Días 10-12
En estos días el mesodermo extraembrionario
nota 4
se dividirá en la somatopleura (parte que recubre la capa interna
del trofoblasto) y la esplacnopleura (parte que recubre al saco
vitelino)
- Día 13
El hipoblasto dará lugar a otras células que se desplazarán hacia
abajo. Sustituyendo a las células de la membrana exocelómica, formando
el saco vitelino secundario o definitivo.
Los restos de la membrana de Heuser
nota 5
llegan al polo inferior como una
bolita de células (el quiste exocelómico) que se reabsorberá.
El celoma se expandirá dando lugar a una cavidad extramebrionaria; a
excepción del lugar del pedículo de fijación, que se convertirá en el
cordón umbilical una vez desarrollados los vasos.
1.5
Gástrula. Disco germinativo trilaminar 
La gastrulación es el proceso mediante el cual se establecen las tres
hojas germinativas. A saber: ectodermo, mesodermo y endodermo.
El epiblasto es el origen de todas las capas germinativas del embrión,
y las células de estas tres capas serán la fuente de todos los tejidos
y órganos del embrión.
En la superficie del epiblasto aparecerá un acúmulo de células que
producirán un pequeño agujero, la fosa o gotera primitiva. Al relieve
que se produce a su alrededor se le conoce como Nódulo de Hensen y al
conjunto de estas dos estructuras y el surco por donde se invaginarán
nota 6
las células se le conoce como linea primitiva.
Así se forman:
-Endodermo. Son las células que se han invaginado y que
desplazan al hipoblasto
-Mesodermo. Son las células que se ubican entre el
epiblasto y el endodermo
-Ectodermo. Son las células que se quedan en el
epiblasto
Por la linea primitiva seguirán penetrando las células que rellenan el
disco. La línea primitiva llega hasta la membrana cloacal (zona caudal
donde están unidos ectodermo y endodermo). Al sumarse cada vez más
células en el mesodermo intraembrionario empiezan a propagarse en
dirección lateral y cefálica, llegando al borde del disco donde
contactan con el mesodermo extraembrionario. En dirección cefálica,
las células pasan a cada lado de la lámina precordal (futura membrana
bucofaríngea) para unirse por delante de esta donde se forma una
región que se conoce como mesodermo cardiogénico o mesocardio. Esta
zona tendrá forma de herradura.
Una estructura importante que se formará en esta época al mismo nivel
es la notocorda, la cual inducirá al sistema nervioso a su desarrollo.
Además, durante esta etapa se determinan los destinos finales de las
células que migran a través de la línea primitiva:
-las células que migran a través de los bordes laterales
del
nódulo y desde el extremo craneal, formarán el mesodermo paratocordal
o paraxial.
-Las células que migran a través de la región media de la
línea formarán el mesodermo intermedio.
-Las células que migran a través de la parte caudal de la línea
formarán el mesodermo distal o lámina lateral.
El embrión se desarrollará en sentido cefalocaudal: la gastrulación
prosigue en los segmentos caudales (hasta el término de la cuarta
semana) mientras las estructuras craneales ya están en proceso de
diferenciación.
-------------------------------
nota1: Valero M., 2003.
nota 2: Ibidem
nota 3: Sadler T.W., 2005,pags.55-62
nota 4: Mesodermo extraembrionario:mesodermo que
cubre los sacos vitelinos primario y secundario durante la segunda
semana. Se cree que surge del epiblasto en el extremo caudal del disco
embrionario bilaminar; migra para formar dos capas que gradualmente
separan el amnios y el trofoblasto (Mesodermo extraembrionario,
2002,p.483)
nota 5: Membrana de Heuser: membrana de células
que tapiza la cavidad del saco vitelino primitivo
nota 6: Invaginación:plegamiento de una parte
dentro de otra (Invaginación, 2002, p.382)
2. APARATO CIRCULATORIO.
FUNCIONAMIENTO FISIOLÓGICO
2.1
Actividad durante la vida fetal 
En la circulación fetal, la sangre oxigenada penetra en el cuerpo por
la vena umbilical izquierda. En el conducto venoso, esta sangre se
mezcla con un pequeño volumen de sangre portal desoxigenada y a
continuación penetra en la vena cava inferior (VCI) donde se mezcla
con la sangre desoxigenada que retorna del tronco y las extremidades
inferiores. En la aurícula derecha, el flujo sanguíneo, aún muy
oxigenado, es derivado en su mayor parte por el agujero oval hacia la
aurícula izquierda. La sangre oxigenada que penetra en la aurícula
derecha fetal procedente de la VCI y la sangre desoxigenada que llega
por la vena cava superior forman dos corrientes diferentes desde el
punto de vista hemodinámico que apenas se mezclan en la aurícula. Esta
separación de los flujos se debe en parte a la forma y a la posición
de la válvula de la VCI.
En la aurícula izquierda, la sangre oxigenada que llega desde la
aurícula derecha se mezcla con una cantidad muy pequeña de sangre
procedente de los pulmones transportada por las venas pulmonares.
Durante la vida intrauterina, la sangre que fluye por los pulmones es
muy escasa, ya que la resistencia vascular de los pulmones fetales
colapsados es muy elevada. La sangre oxigenada del ventrículo
izquierdo es bombeada hacia la aorta para que se distribuya primero
por la cabeza, el cuello y las extremidades superiores y después, a
través de la aorta descendente, por el tronco y las extremidades
inferiores. Cuando la sangre penetra en la aorta descendente, se
mezcla con la sangre desoxigenada que ha derivado a través del
conducto arterioso. Esta sangre procede en su mayor parte de la que
penetra en la aurícula derecha por la vena cava superior y que es
expulsada a través del ventrículo derecho y el tronco de la arteria
pulmonar. Por tanto, la sangre que la circulación fetal envia a la
cabeza, el cuello y las extremidades superiores está mucho más
oxigenada que la que envía hacia el tronco y las extremidades
inferiores. Una vez que la aorta descendente ha distribuido sangre al
tronco y las extremidades inferiores, el resto penetra en las arterias
umbilicales y vuelve a la placenta para ser oxigenada.
2.2 Cambios en el momento del nacimiento 
La transición de la dependencia que tiene el feto del aporte materno a
través de la placenta a la existencia relativamente independiente del
recién nacido en el mundo exterior conlleva cambios espectaculares del
patrón circulatorio en el momento del nacimiento.
Tan pronto como el recién nacido hace su primera inspiración se
produce la separación de los circuitos pulmonar y sistémico,
organizándose en serie. Cuando los alvéolos se llenan de aire, los
vasos pulmonares cerrados se abren y la resistencia vascular pulmonar
desciende bruscamente. La apertura de los vasos pulmonares parece ser
una respuesta directa al oxígeno, ya que la hipoxia del recién nacido
puede hacer que se produzca la constricción de los vasos pulmonares.
Al mismo tiempo la constricción espontánea (o el pinzamiento
obstétrico) de los vasos umbilicales interrumpe el flujo procedente de
la placenta.
La apertura de la circulación pulmonar y la interrupción del flujo
umbilical causan cambios de la presión y el flujo, haciendo que el
conducto arterioso se contraiga y que el agujero oval se cierre.
Cuando se abre la circulación pulmonar, el descenso de la presión en
el tronco de la arteria pulmonar parece provocar una ligera inversión
del flujo de sangre aórtica oxigenada a través del conducto arterioso.
Parece que este incremento local de la presión de oxígeno induce la
constricción del conducto arterioso, que sucede normalmente en las 10
a 15 horas siguientes al parto en los recién nacidos a término.
Por el contrario, el cierre inicial del agujero oval es un efecto
estrictamente mecánico de la inversión de las presiones entre ambas
aurículas. La apertura de la vascularización pulmonar y la
interrupción del flujo umbilical reducen la presión en la aurícula
derecha, mientras que el brusco aumento del retorno venoso pulmonar
eleva la presión en la aurícula izquierda. El cambio de presiones
resultante empuja al flexible septum primum contra el septum secundum
más rígido, lo que se traduce en el cierre funcional del agujero oval.
Normalmente, el septum primum y el septum secundum se fusionan hacia
los tres meses de vida.
En algunos niños, el conducto venoso también se cierra poco después
del nacimiento. Sin embargo, este cierre precoz del conducto venoso no
es imprescindible para el recién nacido, ya que la sangre no fluye ya
por la vena umbilical.
Parece que las prostaglandinas desempeñan un papel importante en el
mantenimiento de la permeabilidad del conducto venoso durante la vida
intrauterina, pero no se conoce cuál es la señal que aparentemente
determina la constricción activa de este canal tras el nacimiento.
La circulación quedará de la siguiente manera:
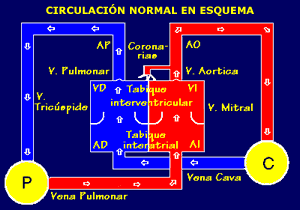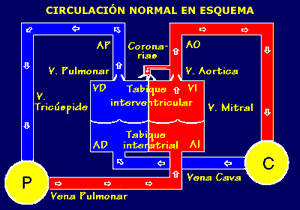
Figura 1. Circulación en el recién nacido.
Obsérvese los cambios que se dan en el patrón circulatorio: el cierre
del agujero oval y la importancia de la circulación pulmonar.
(Villagrá F., 2004)
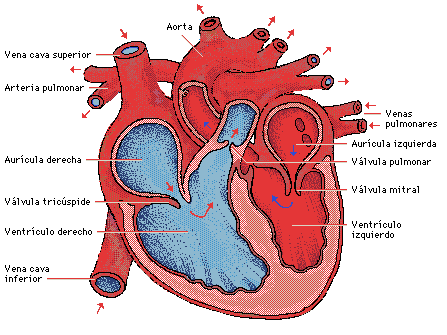
|
La sangre sin oxígeno (azul) llega a la aurícula derecha (AD) a través
de las venas cavas (VSC y VCI); de la aurícula derecha pasa al
ventrículo derecho (VD) a través de la válvula tricúspide. El
ventrículo derecho se contrae y envía la sangre a la arteria pulmonar
(AP) a través de otra válvula (la pulmonar) que evita que la sangre
retroceda hacia el ventrículo. La arteria pulmonar se bifurca en dos
arterias una para el pulmón derecho y otra para el izquierdo (en el
esquema de la circulación normal, sólo se presenta una arteria
pulmonar). En el pulmón se oxigena la sangre y regresa ya oxigenada
(roja) a la aurícula izquierda (AI) a través de las venas pulmonares.
De la aurícula izquierda pasa al ventrículo izquierdo (VI) a través de
la válvula mitral y del ventrículo izquierdo a la aorta (Ao) a través
de otra válvula (aórtica). De la aorta nacen innumerables ramas que
llevan la sangre a todos los órganos y tejidos. Las primeras de estas
ramas son las arterias coronarias que llevan sangre oxigenada (roja)
al propio corazón, a la masa muscular cardíaca o miocardio de la que
extrae el oxígeno necesario para seguir latiendo. Los demás órganos
también extraen el oxígeno. La sangre ya sin oxígeno (azul) regresa al
corazón, a la aurícula derecha, a través de las venas cavas (VCS y
VCI), cerrándose el ciclo
3. CARDIOPATIAS CONGÉNITAS
3.1 Defectos congénitos. Alteraciones en la circulación 
Las anomalías cardíacas y vasculares integran la categoría más grande
de defectos congénitos humanos, responsables de un 1% de las
malformaciones de los niños nacidos vivos .
nota 7
La incidencia entre los mortinatos es diez veces más alta. Se estima
que el 8% de las malformaciones cardíacas se deben a factores
genéticos, el 2% son causadas por agentes ambientales y la mayoría son
provocadas por una compleja interacción entre las influencias
genéticas y los agentes ambientales (causas multifactoriales) .
nota8
Como ejemplos clásicos de teratógenos cardiovasculares se encuentran
el virus de la rubéola y la talidomida, aunque existen otros como la
isotretinoína (vitamina A), el alcohol, y muchos otros compuestos. Las
enfermedades maternas, como la diabetes insulinodependiente y la
hipertensión se asocian también con la producción de anomalías
cardíacas. Las anomalías cromosómicas se asocian con malformaciones
cardíacas, ya que un 6 a 10% de los recién nacidos con defectos
cardíacos tienen una anomalía cromosómica no balanceada .
nota 9
Además, en el 33% de los niños con anomalías cromosómicas existe una
cardiopatía congénita con una incidencia cercana al 100% en niños con
trisomía 18 .
nota 10
Por último, las malformaciones cardíacas están vinculadas con
diversos síndromes genéticos, que incluyen anomalías craneofaciales,
como los síndromes de DiGeorge, de Goldenhar y de Down.
Cabe destacar que las cardiopatías llevan asociadas defectos en
la circulación general. Sobre estos aspectos (malformaciones y
alteraciones en la circulación como consecuencia de las mismas)
profundizaremos en el capítulo.
3.2 Primeros estadios del desarrollo 
El sistema vascular aparece hacia la mitad de la tercera semana,
cuando el embrión ya no es capaz de satisfacer sus requerimientos
nutritivos exclusivamente por difusión.
Como hemos mencionado en el apartado anterior, las células cardíacas
progenitoras se encuentran en el epiblasto, ubicadas inmediatamente
por fuera de la línea primitiva. Desde allí migran a través de
esta.
Las células avanzan hacia el cráneo y se disponen rostralmente a la
membrana bucofaríngea y a los pliegues neurales, aquí se ubican en la
hoja esplácnica de la lámina lateral del mesodermo. En este momento,
en el estadio de desarrollo presomítico tardío, el endodermo faríngeo
subyacente las induce a formar mioblastos cardíacos. Los islotes
sanguíneos también aparecen en este mesodermo, donde darán origen a
células y vasos sanguíneos por el proceso de vasculogénesis. Con el
tiempo los islotes se unen y constituyen un tubo con forma de
herradura revestido de endotelio y rodeado de mioblastos. Esta región
se conoce como campo cardiogénico; la cavidad intraembrionaria
situada por encima de esa región formará después la cavidad
pericárdica.
Además de la región cardiogénica , aparecen a ambos lados otros
islotes sanguíneos, que se disponen en paralelo y próximos a la linea
media del escudo embrionario. Estos islotes forman un par de vasos
longitudinales, las aortas dorsales.
Las aortas dorsales se fusionarán a los tubos endocárdicos antes del
plegamiento.
3.3 Formación y posición del tubo cardíaco

En un principio, el tubo cardíaco está situado por delante de la
mebrana bucofaríngea y de la placa neural. Sin embargo, al producirse
el cierre del tubo neural y la formación de las vesículas cerebrales,
el sistema nervioso central crece tan rápidamente en dirección
cefálica que se extiende sobre el área cardiogénica central y la
futura cavidad pericárdica. Como consecuencia del crecimiento del
cerebro y el plegamiento cefálico del embrión, la membrana
bucofaríngea es traccionada hacia delante, mientras que el corazón y
la cavidad pericárdica se sitúan primero en la región cervical y
finalmente en el tórax.
Simultáneamente con la flexión cefalocaudal, el embrión también se
pliega lateralmente. Como resultado los dos primordios cardíacos se
fusionan en sus regiones caudales, salvo en los extremos más caudales.
El corazón se convierte así en un tubo cardíaco en continua expansión
que consta de un revestimiento endotelial interno y una capa
miocárdica externa. Recibe el flujo venoso por su polo caudal y
comienza a bombear la sangre por el primer arco aórtico hacia la aorta
dorsal desde su polo craneal.
El tubo cardíaco en desarrollo sobresale gradualmente en la cavidad
pericárdica. Sin embargo, en un principio, el tubo permanece unido al
lado dorsal de la cavidad pericárdica por medio de un pliegue de
tejido mesodérmico: el mesocardio dorsal (nunca se forma el mesocardio
ventral). Durante el desarrollo ulterior desaparece el mesocardio
dorsal y se crea un seno pericárdico transverso que conecta ambos
lados de la cavidad pericárdica. Ahora el corazón se haya suspendido
en la cavidad por los vasos sanguíneos en sus polos craneal y caudal.
Mientras se registran estos fenómenos, el miocardio se va engrosando y
secreta una gruesa capa de matriz extracelular, rica en ácido
hialurónico que lo separa de endotelio. Además las células
mesoteliales de la región de seno venoso migran sobre el corazón para
formar el epicardio.
De este modo el tubo cardíaco consta de tres capas: a) endocardio, que
forma el revestimiento endotelial interno del corazón; b) miocardio,
que constituye la pared muscular; c) epicardio o pericardio visceral
que cubre el exterior del tubo. Esta capa externa es la responsable de
la formación de las arterias coronarias, incluidos su revestimiento
endotelial y músculo liso.
3.4 Formación del asa
cardíaca 
En el vigésimo primer día, aparecen en el tubo cardíaco una serie de
estrechamientos (surcos) y dilataciones.
Durante las cinco semanas siguientes, estas dilataciones contribuyen
a la formación de las distintas cavidades cardiacas. Empezando por el
extremo inferior (de entrada), el seno venoso se forma parcialmente a
partir de la confluencia de las astas sinusales izquierda y derecha
con el drenaje de las venas cardinales comunes. En posición cefálica
respecto al seno venoso, las siguientes dos cavidades son la aurícula
primitiva y el ventrículo, separadas por el surco auriculoventricular.
La aurícula primitiva dará lugar a parte de las dos aurículas
definitivas y el ventrículo originará la mayor parte del ventrículo
izquierdo. El ventrículo está separado de la siguiente expansión, el
bulbo cardíaco por el surco bulboventricular. Debido a que la parte
inferior del bulbo cardíaco dará lugar a la mayor parte del
ventrículo derecho, este surco también se denomina surco
interventricular. El extremo superior del bulbo cardiaco también se
denomina cono tronco. Esta región cardiaca dará lugar a las regiones
de salida distales de los ventrículos derecho e izquierdo incluyendo
el conus cordis y el tronco arterioso. El tronco arterioso finalmente
se divide para formar la aorta ascendente y el tronco de la pulmonar y
se conecta en su extremo superior a una dilatación que a veces recibe
el nombre de saco aórtico. El saco aórtico se continua con el primer
arco aórtico y finalmente, con los otros cuatro arcos aórticos. Los
arcos aórticos forman arterias principales que irrigan la cabeza y el
tronco.
Ya el día 23 comienza a doblarse. La porción cefálica del tubo se
pliega en dirección ventral y caudal y hacia la derecha, mientras que
la porción auricular (caudal) lo hace en dirección dorsocraneal y a la
izquierda. Este plegamiento, que se puede deber a los cambios de la
morfología celular, forma el asa cardiaca y se completa a los 28 días.
El resultado del giro es la colocación de las cuatro cavidades del
corazón en la adecuada relación espacial respecto de las demás. El
resto del desarrollo cardíaco consiste en la remodelación de estas
cavidades y el desarrollo de los tabiques y válvulas apropiados.
3.4.1 Anomalías en la formación del asa cardíaca

La dextrocardia, o sea, la ubicación del corazón en el lado derecho
del tórax en vez del izquierdo, es provocada porque el asa cardiaca se
forma hacia la izquierda en lugar de la derecha.
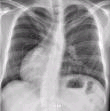
Figura 2. Radiografía de neonato que sufre
dextrocardia.(Pestronk A.,2005) |
La dextrocardia puede coincidir con el situs inversus, que es una
inversión completa de la simetría de todos los órganos.
El situs inversus, que se observa en uno de cada 7000 individuos,
generalmente tiene una fisiología normal, a pesar de que existe un
leve riesgo de defectos cardíacos nota 11 .
En otros casos la determinación de la asimetría derecha/ izquierda es
azarosa, de modo que algunos órganos están invertidos y otros no, lo
que se conoce como heterotaxia. Estos casos se clasifican como
secuencias de lateralidad.
Los pacientes con estas afecciones parecen tener un predominio de
lateralidad del lado izquierdo o derecho. El bazo refleja las
diferencias; aquellos con bilateralidad del lado izquierdo tienen
poliesplenia; aquellos con bilateralidad del lado derecho tienen
asplenia o bazo hipoplásico. Los pacientes con secuencia de
lateralidad muestran además una incidencia incrementada de otras
malformaciones, especialmente defectos cardiacos. Los genes
reguladores de la lateralidad se expresan durante la gastrulación.
3.5 Formación del seno venoso 
El corazón empieza a latir el vigésimo segundo día y entorno al
vigésimo cuarto día, la sangre comienza a circular por todo el
embrión. El retorno venoso al principio ingresa en las astas sinusales
izquierda y derecha a través de las venas cardinales comunes. Sin
embargo, en las siguientes semanas el sistema venoso se remodela, de
forma que toda la sangre venosa sistémica ingresa en el asta sinusal
derecha a través de las venas cava superior e inferior. Al cambiar
el flujo venoso hacia la derecha, el asta sinusal izquierda deja de
crecer y se transforma en un pequeño saco venoso en la pared posterior
del corazón. Esta estructura da lugar al seno coronario y a la pequeña
vena oblicua de la aurícula izquierda. El seno coronario recibirá la
mayor parte de la sangre que drena la circulación coronaria del
músculo cardíaco.
A medida que aumentan de tamaño el asta sinusal derecha y las venas
cavas, para acomodarse al rápido crecimiento del resto del corazón, el
lado derecho del seno venoso se incorpora progresivamente a la pared
posterior de la aurícula en desarrollo, desplazando la mitad derecha
original de la pared auricular primitiva en dirección ventral y hacia
la derecha.
El crecimiento diferencial del seno venoso derecho también empuja al
vestigio del asta sinusal izquierda ( el futuro seno coronario) hacia
la derecha. La porción de aurícula constituida por la incorporación
del seno venoso pasa a denominarse sinus venarum, mientras que el lado
derecho original de la aurícula primitiva se convierte en una
membrana de tejido ventral diminuta denominada orejuela derecha. La
orejuela se puede distinguir en el corazón adulto por la disposición
trabecular en forma de peine de su pared, que contrasta con la pared
lisa del sinus venarum.
Este proceso de invaginación del seno venoso derecho empuja a las
aperturas de los orificios de las venas cavas superior e inferior y
del futuro seno coronario (anterior asta izquierda del seno venoso)
hacia la pared posterior de la aurícula derecha definitiva, donde dan
lugar a los orificios de las venas cavas superior e inferior y al
orificio del seno coronario. Mientras ocurre esto, dos membranas
tisulares, las válvulas venosas izquierda y derecha, se desarrollan a
cada lado de los tres orificios por encima de los orificios
senoauriculares, las válvulas izquierda y derecha se unen para formar
un tabique transitorio denominado septum spurium. La válvula izquierda
al final entra a formar parte del septum secundum, uno de los tabiques
que contribuye a la separación de las aurículas definitivas. La
válvula venosa derecha, por el contrario, permanece intacta y forma la
válvula de la vena cava inferior y la válvula del seno coronario.
Por encima de la válvula de la vena cava inferior, un repliegue de
tejido denominado cresta terminal delimita ahora la orejuela
trabeculada derecha, de la pared lisa del sinus venarum.
La cresta terminal contiene la fibras que transmiten el impulso de la
región marcapasos primaria del corazón (el nodo senoauricular) hacia
un centro marcapasos secundario, el nodo auriculoventricular. Este
tracto de fibras forma parte del sistema de conducción que canaliza la
difusión de la corriente eléctrica de despolarización a través del
corazón y organiza por tanto el latido miocárdico.
Mientras la aurícula derecha experimenta su remodelación durante la
cuarta y quinta semanas, la aurícula izquierda sufre un proceso en
cierto modo similar. A comienzos de la cuarta semana, la aurícula
primitiva proyecta una vena pulmonar. Esta venas ramifica casi
inmediatamente en una rama derecha y otra izquierda, que se vuelven a
bifurcar hasta alcanzar un total de cuatro venas pulmonares. Estas
venas crecen hacia los pulmones, donde se anastomosan con las venas
que se están desarrollando en el mesodermo que reviste las yemas
bronquiales.
Durante la quinta semana, un proceso de invaginación incorpora el
tronco y las dos primeras ramificaciones del sistema venoso pulmonar a
la pared posterior del lado izquierdo de la aurícula primitiva, donde
formarán la pared lisa de la aurícula izquierda definitiva. El lado
izquierdo trabeculado de la aurícula primitiva se desplaza
ventralmente y hacia la izquierda, donde se convertirá en la orejuela
izquierda vestigial. Como resultado de este proceso de invaginación,
el sistema venoso pulmonar se abre a la aurícula al principio a través
de un único orificio amplio, después transitoriamente a través de dos
orificios y finalmente, a través de los cuatro orificios de las cuatro
venas pulmonares definitivas.
3.6 Formación de los
tabiques cardíacos. Anomalías en la formación de los tabiques
cardíacos 
Los principales tabiques del corazón se forman entre el vigésimo
séptimo y el trigésimo séptimo día de desarrollo cuando el embrión
aumenta de longitud desde 5 mm hasta 16 ó 17 mm, aproximadamente. Un
mecanismo de formación del tabique incluye a dos masas de tejido de
crecimiento activo que se aproximan entre sí hasta fusionarse, lo cual
divide el interior en dos canales separados. Este tabique puede
formarse también por el crecimiento activo de una masa de tejido única
que continua su expansión hasta alcanzar el lado opuesto de la
cavidad. La formación de estas masas de tejido depende de la síntesis
y el depósito de matrices extracelulares y de la proliferación
celular. Las masas se denominan almohadillas endocárdicas y se forman
en las regiones auriculoventricular y troncoconal. En estos sitios
contribuyen a la formación de los tabiques interauricular e
interventricular (porción membranosa), los canales y válvulas
auriculoventriculares, y los canales aórtico y pulmonar.
Otra manera de formación de tabiques no involucra a las almohadillas
endocárdicas. Si, por ejemplo deja de crecer una banda angosta de
tejido de la pared de la aurícula o del ventrículo en tanto que las
regiones que se encuentran a ambos lados se expanden rápidamente, se
forma una cresta angosta entre las dos porciones en crecimiento. Al
continuar el crecimiento de estas porciones en expansión a ambos lados
de esa pared estrecha, las dos paredes se aproximan entre sí y pueden
llegar a fusionarse para formar un tabique. El tabique no divide por
completo la cavidad original, sino que deja un estrecho canal de
comunicación entre las dos porciones expandidas. Por lo general, los
tejidos adyacentes en proliferación contribuyen a su cierre en forma
secundaria. Este tipo de tabique divide parcialmente las aurículas y
los ventrículos.
Debido a su localización clave, las anomalías en el desarrollo de las
almohadillas endocárdicas son la base de muchas malformaciones
cardíacas, como las comunicaciones interauricular e interventricular y
los defectos de los grandes vasos (p. Ej; tansposición de los grandes
vasos y tetralogía de Fallot). Dado que la población celular de las
almohadillas troncoconales comprende células de la cresta neural y
como estas células contribuyen también en gran medida al desarrollo de
la cabeza y el cuello, las anomalías de estas células, producidas por
agentes teratógenos o causas genéticas, suelen producir defectos
cardíacos y craneofaciales en el mismo individuo.
3.6.1 Tabicamiento de la aurícula común 
Aproximadamente, en el vigésimo sexto día, mientras progresa la
remodelación auricular, la raíz de la aurícula se deprime a lo largo
de la linea media por el contronco suprayacente. En el vigésimo octavo
día, este surco que va profundizándose produce un borde de tejido con
forma de cresta denominado septum primum que comienza a extenderse en
la aurícula desde la pared superoposterior .
nota 12
Durante la quinta semana el borde libre del septum primum crece en
sentido caudal hacia el canal auriculoventricular, separando
progresivamente las incipientes aurículas derecha e izquierda. El
orificio en disminución entre las aurículas se denomina ostium primum.
Al mismo tiempo que crece el septum primum hacia abajo, cuatro
expansiones de tejido se desarrollan en el endocardio, en la periferia
del canal auriculoventricular. Estos engrosamientos se denominan
almohadillas endocárdicas izquierda, derecha, inferior y superior.
Determinadas señales procedentes del miocardio adyacente inducen en el
endocardio la formación de estas almohadillas. A finales de la sexta
semana las almohadillas superior e inferior se encuentran y se
fusionan, formando el septum intermedium que divide el canal
auriculoventricular común en los canales auriculoventriculares derecho
e izquierdo. A finales de la sexta semana también, el borde en
crecimiento del septum primum se fusiona con el septum intermedium.
Este acontecimiento cierra el ostium primum.
Sin embargo, antes del cierre del ostium primum la muerte celular
programada en el área cercana al borde superior del septum primum
origina pequeñas perforaciones que coalescen para formar un nuevo
orificio, el ostium secundum. Por tanto, se abre un nuevo canal de
derivación derecha- izquierda antes de que el anterior se cierre.
Mientras está creciendo el septum primum una segunda cresta tisular en
forma de media luna aparece en el techo de la aurícula derecha justo
al lado del septum primum. Este septum secundum es grueso y muscular,
al contrario que el fino y membranoso septum primum. El borde del
septum secundum crece en sentido posteroinferior, pero su crecimiento
se interrumpe antes de alcanzar el septum intermedium dejando
un orificio abierto, el orificio oval cercano al suelo de la aurícula
derecha. Por tanto durante el resto del crecimiento fetal, la sangre
que deriva de la aurícula derecha a la aurícula izquierda atraviesa
dos aberturas escalonadas: el orificio oval cerca del suelo de la
aurícula derecha y el ostium secundum cerca del techo de la aurícula
izquierda. Esta derivación se cierra al nacer por la brusca dilatación
de la vascularización pulmonar, combinada con la interrupción del
flujo umbilical, que invierte la diferencia de presión entre las
aurículas y empuja el flexible septum primum contra el más rígido
septum secundum.
3.6.1.1 Anomalías en el tabicamiento de la aurícula común 
La comunicación interauricular (defecto del tabique interauricular) es
un cardiopatía congénita con una incidencia de 6’4 cada 10.000
nacimientos y una prevalencia de 2:1 en las mujeres frente a los
varones .
nota 13
Una de las anomalías más importantes es el defecto tipo ostium
secundum, caracterizado por un orificio de tamaño apreciable entre las
aurículas derecha e izquierda, a causa de la muerte celular y la
resorción excesivas del septum primum o del desarrollo insuficiente
del septum secundum. Según el tamaño del orificio puede existir un
importante cortocircuito intracardíaco de izquierda a derecha.
Debido al cortocircuito izquierda-derecha que se produce al pasar
libremente la sangre por la CIA, hay un hiperaflujo pulmonar. La
sangre oxigenada que proviene de la aurícula izquierda, recircula
inútilmente por el pulmón sin pasar por la circulación sistémica y
sobrecarga de trabajo y volumen sanguíneo a los pulmones, ambas
aurículas, el ventrículo derecho y las arterias pulmonares.
La cantidad de sangre que pasa de la aurícula izquierda a la derecha
depende de: 1) tamaño del defecto (mayor a mayor defecto), 2)
diferencia de presión entre ambas cavidades (mayor a mayor
diferencia), 3) distensibilidad ventricular derecha (mayor a mayor
distensibilidad) y 4) resistencias pulmonares y sistémicas (mayor a
menores resistencias pulmonares y mayores sistémicas). En realidad la
sangre de la aurícula izquierda tiene dos caminos alternativos: Hacia
el ventrículo izquierdo y aorta o hacia la aurícula y ventrículo
derecho y los pulmones. Escogerá el que sea más fácil, cómodo, “ancho”
y de menos resistencia. Y este es en general el camino hacia el
ventrículo derecho y pulmones.
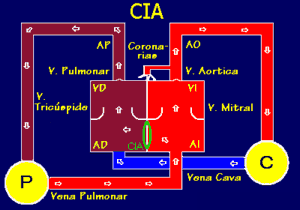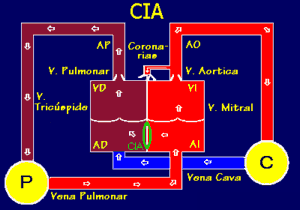
Figura 3. En la
comunicación interauricular la sangre oxigenada pasa por el pulmón
sobrecargando así este sistema. Así se produce la dilatación de las
cavidades derechas. (Villagrá F., 2004) |
Como consecuencia de este cortocircuito, se produce una dilatación de
las cavidades derechas, arteria pulmonar y aurícula izquierda (por la
mayor llegada de sangre desde el pulmón). A la larga, esta dilatación
y en especial la dilatación de ambas aurículas, origina arritmias
(edad >20-30 años) que se acompañan de sintomatología.
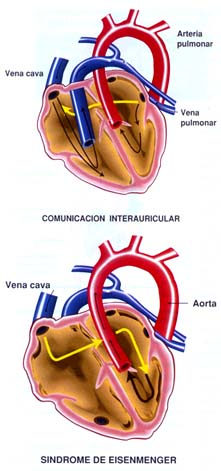
Figura 4. Síndrome de Eisenmenger. En las fases iniciales de
la comunicación interauricular se forma un gradiente de flujo
izquierda –derecha. Con el tiempo, a medida que aumentan las presiones
en el sistema pulmonar aparece una inversión del patrón adoptando una
dirección derecha a izquierda. (Villagrá F.,2004 ) |
El hiperaflujo pulmonar puede ocasionar hipertensión pulmonar también
en personas adultas. Más raro es que se invierta el sentido del
cortocircuito (pase de izquierda-derecha a derecha-izquierda, al
aumentar las resistencias pulmonares y como consecuencia las presiones
del corazón derecho incluida la aurícula derecha), fenómeno conocido
como Síndrome de Eisenmenger.
nota 14
La anomalía más grave de este grupo es la falta completa del tabique
interauricular. Este estado denominado aurícula común o corazón
trilocular biventricular, siempre se acompaña de otros defectos
cardíacos graves. A veces, el agujero oval se cierra durante el
periodo prenatal. Esta anomalía, que recibe el nombre de cierre
prematuro del agujero oval, causa hipertrofia masiva de la aurícula y
del ventrículo derechos y un desarrollo insuficiente del lado
izquierdo del corazón. Suele sobrevenir la muerte poco después del
nacimiento.
3.6.2 Tabicamiento del canal auriculoventricular

El canal auriculoventricular al principio se encuentra en un plano
coronal, entre el lado izquierdo de la aurícula primitiva y el futuro
ventrículo izquierdo. Se han propuesto dos teorías para explicar el
mecanismo mediante el cual el lado derecho del canal se alinea con la
futura aurícula derecha y el ventrículo derecho. Parte de este cambio
puede deberse a la migración activa del canal auriculoventricular
común durante la quinta semana. Por otro lado, el movimiento aparente
hacia la derecha del canal puede deberse enteramente a la obliteración
de la protusión superior interna del surco bulboventricular y al
ensanchamiento del conotronco.
Además, al mismo tiempo que el canal se está desplazando a la derecha
se divide en dos canales derecho e izquierdo por el crecimiento de las
almohadillas endocárdicas superior e inferior. Por tanto, en el
momento en que el canal común se divide en canales auriculoventricular
derecho e izquierdo, estos se encuentran correctamente alineados con
sus respectivas aurículas y ventrículos.
La recolocación que alinea el futuro ventrículo izquierdo con la
porción proximal del tronco arterioso parece deberse a varios factores
que actúan asociados. La disminución del borde bulboventricular por
crecimiento diferencial y el ensanchamiento de la porción proximal del
conus cordis provocan en parte este efecto. También parece desempeñar
cierto papel la pared izquierda del extremo proximal del conus cordis
que se incorpora al ventrículo izquierdo y la expansión diferencial de
la pared derecha del ventrículo derecho y la pared izquierda del
ventrículo izquierdo.
Ambos ventrículos parecen ser estructuras complejas. El ventrículo
derecho deriva principalmente de la parte más inferior del bulbo
cardíaco y de la pared derecha del conus cordis. Además, parte de la
región interna del ventrículo derecho, cerca de la válvula
auriculaventricular tricuspídea, se origina en el ventrículo
primitivo y es arrastrada hasta el ventrículo derecho durante la
recolocación del canal auriculoventricular. El ventrículo izquierdo
definitivo deriva del ventrículo primitivo y de la pared izquierda del
conus cordis.
3.6.2.1 Anomalías en el tabicamiento del
canal auriculoventricular 
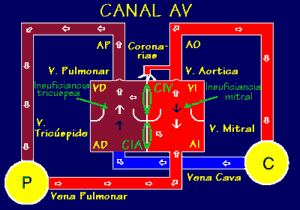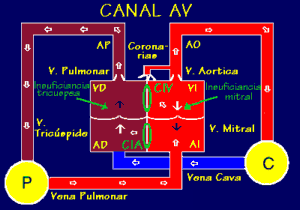
Figura 5. La
persistencia del canal auriculoventricular se debe a un defecto en la
formación de los tabiques endocárdicos o almohadillas endocárdicas.
(Villagrá F., 2004) |
Las almohadillas endocárdicas del canal auriculoventricular no
sólo dividen a este canal en orificios derecho e izquierdo, sino que
también participan en la formación de la porción membranosa del
tabique interventricular y en el cierre del ostium primum. Esta región
tiene forma de cruz, los tabiques interauricular e interventricular
forman la parte vertical y las almohadillas auriculoventriculares la
transversal. Un signo importante en ecografías del corazón es la
integridad de esta cruz. Cuando las almohadillas no se fusionan, el
resultado es un canal auriculoventricular persistente combinado con un
defecto del tabique cardíaco.
Este defecto del tabique tiene un componente auricular y otro
ventricular, separados por valvas anormales en el orificio
auriculoventricular único.
En ocasiones, las almohadillas endocárdicas del canal
auriculoventricular se fusionan sólo en parte. El resultado es una
comunicación interauricular; sin embargo, el tabique interventricular
se cierra. Esta malformación, denominada defecto tipo ostium primum,
suele acompañarse de una hendidura de la valva anterior de la válvula
tricúspide.
La atresia tricuspídea comprende la obliteración del orificio
auriculoventricular derecho y se caracteriza por la falta o fusión de
las válvulas de la tricúspide. El defecto se acompaña invariablemente
de: a) persistencia del agujero oval, b) defecto del tabique
interventricular (comunicación interventricular), c) hipoplasia del
ventrículo derecho y d) hipertrofia del ventrículo izquierdo.
3.6.3. Tabicamiento del ventrículo común. Desarrollo de las válvulas
cardíacas. División de los tractos descendentes

Una vez que los canales auriculoventriculares, los ventrículos y
los tractos de salida cardíacos están alineados correctamente, todo
está preparado para que se desarrollen las siguientes fases de la
morfogénesis cardíaca: la tabicación ventricular, la división de los
tractos de salida en aorta ascendente y tronco de la pulmonar y el
desarrollo de las válvulas cardíacas.
A) Tabicamiento ventricular
A finales de la cuarta semana, la parte inferior del surco
bulboventricular comienza a protuir en la luz cardíaca, en la
interfase entre las cavidades ventriculares derecha e izquierda. Este
tabique parece formarse al acercarse más estrechamente las paredes en
crecimiento de las dos cavidades ventriculares. Sin embargo, el
crecimiento de este tabique muscular ventricular se interrumpe a
mediados de la séptima semana antes de que su borde libre se encuentre
con el septum intermedium. Esta interrupción del crecimiento es
crucial: si se produjera la fusión demasiado pronto el ventrículo
izquierdo no llegaría a contactar con el tracto de la salida
ventricular.
Al mismo tiempo que el tabique muscular ventricular se está
formando, el miocardio comienza a engrosarse y aparecen las trabéculas
o crestas miocárdicas en la superficie interna de ambos ventrículos.
La porción anterior del tabique ventricular muscular es trabeculada y
se denomina pliegue ventricular primario o septum. La porción
posterior del tabique es lisa y se denomina tabique interior debido a
su proximidad a los canales auriculoventriculares. En la pared derecha
del tabique muscular ventricular, el límite entre el pliegue
trabeculado primario y el tabique interno viene determinado por una
trabeculación prominente y constante denominada la trabécula
septomarginal o banda moderadora. Esta estructura conecta el tabique
muscular con el músculo papilar anterior, que ha comenzado a formarse
como parte de la válvula auriculoventricular derecha.
B) Desarrollo de las válvulas cardíacas
Las válvulas auriculoventriculares comienzan a formarse entre la
quinta y la octava semanas. Socavando el miocardio que rodea los
canales auriculoventriculares derecho e izquierdo se forman las
cúspides o valvas anterior y posterior a los lados de ambos canales.
Estas valvas se encuentran firmemente arraigadas en el borde de los
canales pero se piensa que no se originan por diferenciación de las
almohadillas endocárdicas adyacentes. El borde libre de cada valva se
fija a las paredes ventriculares anterior y posterior por finos
tendones denominados cuerdas tendinosas, que se insertan en pequeñas
prominencias de miocardio denominadas músculos papilares. Las valvas
están diseñadas de forma que cuando se vuelven, permiten la entrada de
la sangre procedente de las aurículas en los ventrículos durante la
sístole, pero cuando los ventrículos se contraen se cierran para
evitar el flujo retrógrado.
La válvula auriculoventricular izquierda sólo tiene valvas
anterior y posterior por lo que se denomina válvula bicúspide (válvula
mitral). La válvula auriculoventricular derecha suele desarrollar
(aunque no siempre) una tercera valva septal de pequeño tamaño durante
el tercer mes y, por tanto, se denomina válvula tricúspide.
C)División de los tractos descendentes
En el momento en que el tabique muscular interventricular deja de
crecer, los dos ventrículos se comunican a través del orificio
interventricular y de la amplia base del conus cordis. La tabicación
posterior de los ventrículos y del tracto de salida debe coordinarse
estrictamente para que el corazón funcione apropiadamente. No es
sorprendente que una gran parte de las malformaciones cardíacas se
deban a errores en este complejo proceso.
La vía de salida cardíaca se divide en dos por las proyecciones o
crestas que crecen desde las paredes opuestas del conus cordis y el
tronco arterioso y que se encuentran en la linea media. Estas crestas
son bulbosas al principio y rellenan la mayor parte de la luz
troncocónica, pero finalmente se adelgazan y fusionan para dar lugar a
un tabique que separa completamente las vías de salida del ventrículo
derecho y del izquierdo. La división final del tronco arterioso para
dar lugar a la aorta ascendente y al tronco de la pulmonar se produce
por una escisión que se desarrolla en el mismo plano del tabique.
Se ha sugerido que hasta tres parejas de proyecciones se fusionan para
formar el tabique final. Una teoría alternativa es que la tabicación
se debe a un solo par de proyecciones troncocónicas que crecen en
ambas direcciones. En ambas, es evidente que la tabicación comienza en
el extremo inferior del tronco arterioso y progresa hacia arriba y
hacia abajo desde ese punto. La separación de los tractos de salida
aórtico y pulmonar se completa cuando las proyecciones troncocónicas
se fusionan con la almohadilla endocárdica inferior y con el tabique
muscular interventricular, completando por tanto la separación de los
ventrículos derecho e izquierdo. El crecimiento de este tabique
ventricular membranoso suele producirse entre la quinta y la octava
semana; sin embargo, la fusión incompleta que produce una comunicación
interventricular es la malformación congénita cardíaca más frecuente.
Las proyecciones que separan los tractos de salida de ambos
ventrículos surgen aparentemente en espiral a lo largo de las paredes
del tronco arterioso y de los tractos de salida de ambos ventrículos.
En consecuencia, los tractos de salida de ambos ventrículos derecho e
izquierdo y, finalmente, de la aorta y del tronco de la pulmonar giran
unos sobre otros de modo helicoidal.
A mediados de la quinta semana, en la punta de cada proyección
troncal, en el extremo inferior del tronco arterioso aparece un
pequeño tubérculo o prominencia. A este nivel, las proyecciones
troncales están arraigadas en las paredes laterales izquierda y
derecha del tronco. Cuando las proyecciones se fusionan para separar
los tractos de salida estos tubérculos laterales se dividen, de manera
que la mitad de cada uno se distribuye a cada uno de los tractos de
salida. Mientras tanto, una segunda pareja de tubérculos se desarrolla
en las paredes anterior y posterior del tronco al mismo nivel. Después
de la tabicación, el tubérculo de la pared anterior se situa en el
canal pulmonar en desarrollo y, el de la pared posterior en el canal
aórtico. Tras la tabicación, cada tracto de salida contiene por tanto
tres tubérculos colocados formando un triángulo: dos formados a partir
de la división de los tubérculos laterales y un tercero que se origina
en la pared troncal anterior o posterior. Estos tubérculos darán lugar
a las valvas de las válvulas semilunares tricuspídeas, que impiden el
flujo retrógrado desde la aorta y la pulmonar a los ventrículos. Las
valvas en forma de copa se forman por la excavación del tejido troncal
inferior situado por debajo del lugar inicial de la formación del
tubérculo. Como resultado de esta excavación, las bases de las valvas
migran hacia abajo durante la maduración de las válvulas. Esta
migración sigue la ruta espiral de los vasos de salida, de forma que
las válvulas parecen rotar ligeramente durante el desarrollo. El
desarrollo de las válvulas semilunares se ha completado en la novena
semana.
nota 15
3.6.3.1 Anomalías en la formación de los tabiques, válvulas cardíacas
y división de los tractos descendentes 
La comunicación interventricular (defecto del tabique ventricular),
que comprende la porción membranosa del tabique, es la malformación
cardíaca congénita más común, que se presenta en forma aislada en doce
de cada diez mil nacimientos.
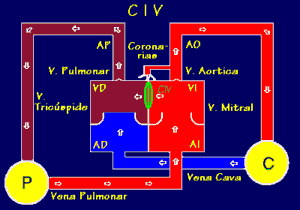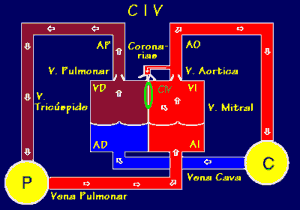
Figura 6. Este
esquema muestra la circulación en comunicación interventricular.
(Villagrá F., 2004) |
Aún cuando puede tratarse de una lesión aislada, también puede
acompañarse de anomalías del tabicamiento de la región troncoconal.
Según el calibre del orificio, el caudal sanguíneo que lleva la
arteria pulmonar puede ser de 1’2 a 1’7 veces más abundante que el de
la aorta. En ocasiones, el defecto no se circunscribe a la porción
membranosa sino que abarca también la porción muscular del
tabique.
En el tabique interventricular existe un agujero por el que pasa
sangre oxigenada (roja) del ventrículo izquierdo (VI), que está a más
presión, al ventrículo derecho (VD) (con menor presión) mezclándose
(color marrón) con la sangre no oxigenada (azul) que proviene de la
aurícula derecha (AD), de forma que regresa al pulmón (P) inútilmente
a oxigenarse estando ya previamente oxigenada. Como consecuencia de
ello el ventrículo derecho, la arteria pulmonar (AP), los pulmones,
las venas pulmonares, la aurícula izquierda (AI) y el ventrículo
izquierdo están sobrecargados inútilmente de flujo sanguíneo y trabajo
hemodinámico, y se dilatan.
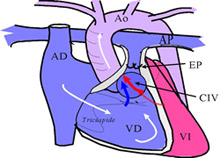
Figura 7.
Detalle del flujo sanguíneo en tetralogía de Fallot (Villagrá F.
2004) |
La tetralogía de Fallot es la anomalía más frecuente de la región
troncoconal y se debe a la división desigual del cono, causada por el
desplazamiento anterior del tabique troncoconal. Esto produce cuatro
alteraciones cardiovasculares: a) estrechamiento de la región
infundibular del ventrículo derecho, es decir, estenosis infundibular
pulmonar; b) comunicación interventricular amplia; c) cabalgamiento de
la aorta que nace directamente arriba del defecto septal, y d)
hipertrofia de la pared ventricular derecha, ocasionada por la alta
presión en ese lado. Esta malformación se presenta con una frecuencia
de 9’6 cada diez mil nacimientos y es compatible con la vida.
nota 16
El tronco arterioso persistente se observa cuando los rebordes
troncoconales no se fusionan ni descienden hacia los ventrículos. En
este caso, cuya frecuencia es de 0’8 cada diez mil nacimientos, la
arteria pulmonar nace un poco por arriba del origen del tronco
indiviso dado que los rebordes participan también en la formación del
tabique interventricular, el tronco persistente siempre se acompaña de
una comunicación interventricular. De tal manera, el tronco no
dividido cabalga sobre ambos ventrículos y recibe sangre de ambos
lados.
La transposición de los grandes vasos se produce cuando el tabique
troncoconal no sigue su curso normal en espiral sino que desciende en
linea recta. En consecuencia, la aorta nace del ventrículo derecho y
la arteria pulmonar del izquierdo. Esta anomalía se presenta en 4’8 de
cada diez mil nacimientos y a veces se acompaña de un defecto de la
porción membranosa del tabique interventricular. Por lo común está
combinada con un conducto arterioso persistente. Dado que las células
de la cresta neural contribuyen a la formación de las almohadillas
troncales, las lesiones de estas células pueden provocar defectos
cardíacos de la región infundibular.

Figura 8.
Transposición de los grandes vasos. Esta cardiopatía lleva asociada
otras: comunicación interauricular y ductus (se indica en verde).
(Villagrá F., 2004) |
La estenosis valvular de la arteria pulmonar o de la aorta se
produce cuando las válvulas semilunares están fusionadas en una
distancia variable. La incidencia de la anomalía es análoga en ambas
regiones: tres a cuatro cada diez mil nacimientos, aproximadamente. En
caso de estenosis valvular de la arteria pulmonar, el tronco de esta
arteria es estrecho o atrésico. El agujero oval permeable es entonces
la única salida para la sangre del lado derecho del corazón. El
conducto arterioso siempre se encuentra permeable y representa la
única vía de acceso a la circulación pulmonar.
En el caso de las estenosis valvular aórtica, la fusión de las
valvas engrosadas puede ser completa de manera que sólo queda un
orificio del calibre de una punta de alfiler. Sin embargo, el calibre
de la aorta puede ser normal.
Cuando la fusión de las valvas semilunares aórticas es completa –
estado denominado atresia valvular aórtica-, la aorta, el ventrículo
izquierdo y la aurícula izquierda muestran un desarrollo insuficiente.
Por lo común, la anomalía se acompaña de un conducto arterioso
permeable, que conduce la sangre a la aorta.
La ectopia caríaca es una anomalía poco frecuente en la que el
corazón se encuentra situado en la superficie del tórax. Esta
malformación depende de la falta de cierre de la pared ventral del
cuerpo del embrión.
---------------------------------
nota 7: Sadler T.W., 2005, p.
253
nota 8:Ibidem
nota 9: Ibidem
nota 10: Ibidem
nota 11: Larsen W.J., 2003, p.187
nota 12:Larsen W.J., 2003, p.169
nota 13:Sadler T.W., 2005, p.254
nota 14: Villagrá F., 2004
nota 15: Larsen W.J., 2003, p.200
nota 16: Sadler T.W., 2005, p.262
4. CONCLUSIONES 
Durante el período fetal se producirá el crecimiento del embrión. Los
órganos estarán ya formados, pero pocos serán funcionales.
El corazón y los vasos sanguíneos comienzan su funcionamiento durante
la 4ª semana. Pero la reestructuración del sistema circulatorio no se
completa hasta el tercer mes y el patrón circulatorio será modificado
definitivamente en el momento del nacimiento, debido a la entrada en
funcionamiento de los pulmones y a la independencia de la madre.
Las cardiopatías pueden ser resultado de fallos genéticos así como
de la transmisión de virus o el paso de agentes teratógenos que
alcanzan al embrión a través de la placenta.
Actualmente existen modernas técnicas diagnósticas que han
comenzado a revolucionar el diagnóstico de las malformaciones
embrionarias y fetales y de las enfermedades genéticas. Estas son,
principalmente: la amniocentesis, la obtención de vellosidades
coriónicas y la ecografía. Con el diagnóstico y si es conveniente, se
puede llevar a cabo cirugía fetal correctora.
5. APÉNDICE BIBLIOGRÁFICO 
- Invaginación en: Dorland. Diccionario Médico Ilustrado de
Bolsillo. Madrid. Mc Graw- Hill Interamericana. 2002
. Larsen W.J. Embriología Humana. Madrid: Elsevier España S.A. 2003
- Mesodermo extraembrionario, en: Dorland. Diccionario Médico
Ilustrado de Bolsillo. Madrid. Mc Graw- Hill Interamericana, 2002
- Pestronk A. Desde: Febreo 2005. Neuromuscular Disease Center.
(en linea). Disponible en:
http://www.neuro.wustl.edu/neuromuscular/syncm.html (figura 2)
- Sadler T.W. Langman .Embriología médica con orientación clínica.
Buenos Aires: Médica Panamericana. 2005.
- Síndrome de Eisenmenger. Mayo 2006. Iladibia.com (en linea).
Disponible en:
http://www.iladiba.com.co/upr/1997/No121997/HTM/cardio2.asp
- Valero M. 20 Junio 2003. Nacer con un corazón diferente (en
linea). El Mundo, edición online. Disponible en:
http://www.elmundo.es/elmundosalud/2003/06/20/pediatria/1056109941.html
(figura 4)
- Villagrá F. Desde: febrero 1998. Actualizada en: Mayo 2004.
Cardiopatías congénitas. (en linea) Disponible en:
http://www.cardiopatiascongenitas.net
(Figuras 1, 3, 5, 6,7, 8)
- Villagrá F. Desde: febrero 1998. Actualizada en: Mayo 2004.
Cardiopatías congénitas. (en linea) Disponible en:
http://www.cardiopatiascongenitas.net

































