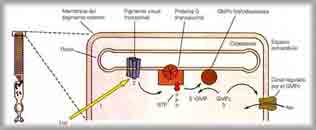
Fase II: La activación de moléculas
de pigmento reduce la concentración citoplasmática de GMPc
En
la oscuridad, dos corrientes predominan en el fotorreceptor:
·
Una
corriente de entrada de sodio que se limita al segmento externo del
fotorreceptor y fluye por los canales regulados por GMPc y que tiende a
despolarizar el receptor.
·
Una
corriente de salida de iones potasio que fluye por canales no regulados y
selectivos para este ión, que tiende a hiperpolarizar el receptor.
Pese
a estos dos grandes flujos, el fotorreceptor puede mantener concentraciones
intracelulares estables de iones sodio y potasio gracias a la elevada
densidad de bombas Na-K que posee
en su segmento interno, y que bombean iones sodio hacia el exterior e iones
potasio hacia el interior de la célula.
En
la oscuridad, la concentración citoplasmática de GMPc es alta, lo que mantiene
abiertos los canales regulados por él, y permite una corriente
de entrada estable, llamada corriente de la oscuridad.
Cuando
el bastón se expone a la luz se produce un aumento de la negatividad del
potencial de membrana del bastón, lo cual supone un estado de hiperpolarización.
Esto es exactamente lo contrario a la disminución de la negatividad, proceso de
despolarizaciòn, que se produce en casi todos los demás receptores
sensoriales.
Pero
¿cómo produce hiperpolarización la activación de la rodopsina? La respuesta
es, que cuando la rodopsina se descompone, disminuye la permeabilidad de la
membrana para los iones de sodio en
el segmento externo del bastón. Esto provoca una hiperpolarización de toda la
membrana del bastón de la siguiente forma:
El
segmento interno del bastón bombea
continuamente sodio desde el interior del bastón hacia el exterior, por lo que
crea un potencial negativo en el interior de toda la célula.
Sin
embargo, el segmento externo del bastón, donde se localizan los discos
fotorreceptores, es completamente distinto: aquí la membrana del bastón, en la
oscuridad es muy permeable a los iones sodio. Por tanto, estos iones pasan de
nuevo al interior del bastón y así neutralizan gran parte de la negatividad
del interior de toda la c‚lula. As¡ pues, en condiciones de oscuridad, cuando
el bastón no está excitado, hay un nivel reducido de electronegatividad
en el interior de la membrana del bastón, que normalmente se encuentra en torno
a -40 milivoltios en lugar de los más habituales -70 mV hallados en la mayoría
de las células excitables.
En
consecuencia, cuando la rodopsina del segmento externo del bastón se expone a
la luz y comienza a descomponerse en opsina y retinal holo-trans, disminuye la
permeabilidad de la membrana al sodio, disminuyendo la conductancia de sodio al
interior del bastón, aunque los iones de sodio continúan siendo bombeados al
exterior en el segmento interno. Así pues ahora salen del bastón más iones de
sodio de los que entran de vuelta. Como son iones positivos, su pérdida del
interior del bastón origina un aumento de la negatividad en el medio
intracelular, y cuanto mayor sea la energía lumínica que incida sobre el bastón,
mayor ser esta electronegatividad, es decir, mayor ser el grado de
HIPERPOLARIZACIÓN.
El
descenso de la permeabilidad de la membrana para el sodio viene regulado por el
GMPcíclico que controla los flujos de iones, abriendo unas clases especiales de
canales iónicos, los canales iónicos
regulados por GMPc, cuya actividad depende a su vez de otros factores:
La
rodopsina activada, por acción de la luz, funciona como una enzima que activa
muchas moléculas de transducina, una proteína G específica presente en su
forma inactiva en las membranas de los discos y en la membrana celular del bastón.
La
transducina activada intercambia guanosintrifosfato (GTP) por guanosindifosfato
(GDP) activando moléculas de fosfodiesterasa.
La
fosfodiesterasa activada es otra enzima que inmediatamente hidroliza muchísimas
moléculas de guanosín monofosfato cíclico ( GMPc ), más de 10 elevado a 5
moléculas de GMPc por segundo; que pasa a 5’-GMP, disminuyendo así la
concentración de GMPc asociado a los canales iónicos.