6. Cuestiones
1-¿Por qué aparecen burbujas de gas durante el transcurso de la reacción?
Las burbujas de gas en la reacción son consecuencia del desprendimiento de CO2.
La reacción global de B-Z la podemos escribir de la siguiente forma:
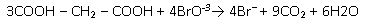
El ácido malónico se oxida en presencia de lo bromato, dando dióxido de carbono, agua e iones bromuro.
2- ¿Se puede utilizar agua potable en la práctica?
En la práctica no es conveniente utilizar agua potable, esta contiene cloro que puede actuar como inhibidor de la reacción.
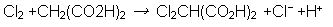
El cloro reacciona fácilmente con el ácido malónico, esto provoca que la reacción se detenga debido a que el cloro consume uno de los reactantes.
Las oscilaciones se detienen y la evolución del potencial con respecto al tiempo es lineal, debido a que el potencial es constante.
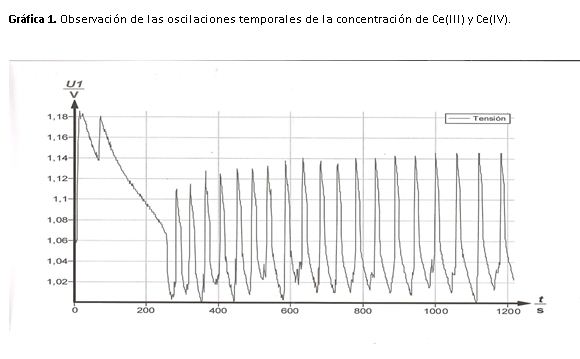
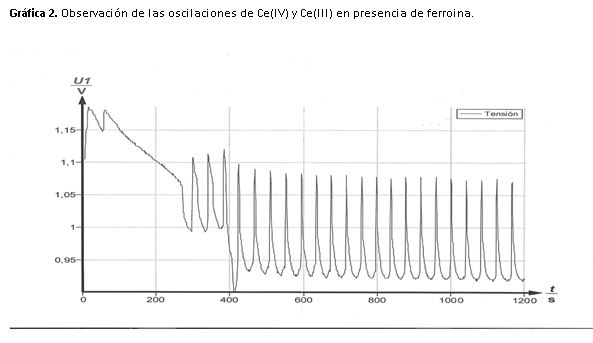
3- Describe los cambios de color que se observan en las disoluciones y relaciónalos con los cambios en la concentración de Ce(III) y Ce(IV) y las formas oxidadas y reducidas del indicador ferroina.
Para analizar los cambios de color de forma que podamos relacionarlos con la concentración de cerio, tomaré como referencia el segundo apartado experimental además de la gráfica obtenida en la experiencia.
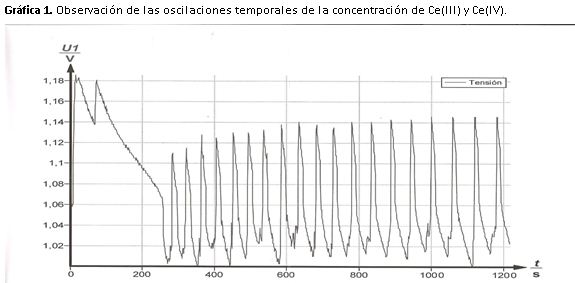
La disolución oscila de amarillo a incoloro, en el máximo de potencial (1,14 V) la disolución es amarilla y en el mínimo (1,02 V) incolora.
Cuando la disolución es amarilla nos indica que la concentración de Ce(IV) es elevada, mientras que cuando es incolora indica que la concentración de Ce(III) es mayor.
Si nos fijamos en la gráfica 1, atendiendo a la forma de los picos podemos ver que los cambios de incoloro a amarillo son rápidos mientras que de amarillo a incoloro se produce un cambio lento y gradual.
Para analizar los cambios en el color de la mezcla de reactivos en presencia del indicador ferroina tomaré como referencia el tercer apartado experimental.
Cuando se adiciona el indicador redox, el color de la disolución oscila de azul a rojo, en el máximo (1,09 V) la disolución es azul, lo que pone de manifiesto que la ferroina está oxidada.
En el mínimo (0,94 V) la disolución es roja, esto nos indica que la ferroina está reducida.
Durante la práctica observamos que la disolución cambia de rojo a azul y esta permanece muy poco tiempo ya que una vez adquiere el color, se va produciendo un cambio gradual a rojo pasando por una serie de colores morados o granates no muy definidos.
Todos estos cambios visuales se pueden interpretar también a través de la gráfica como en el caso anterior.
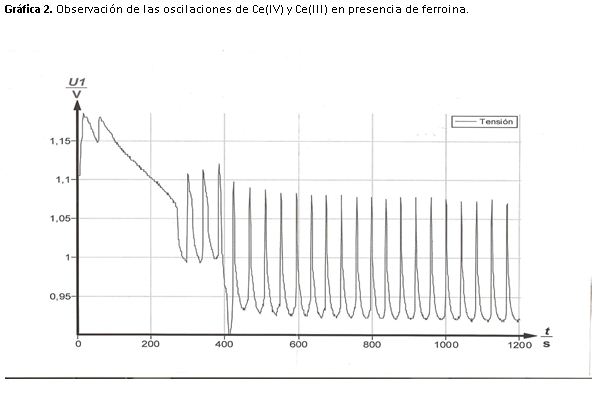
Los picos son finos y la subida de potencia es casi lineal debido a que la reacción es más rápida, en los máximos la concentración de Ce(IV) y ferritina (Fe+3) es elevada el color que vemos es el del indicador (azul).
Para alcanzar el mínimo el cambio es más lento, la concentración que predomina es Ce(III) y ferroina (Fe+2) el color de la disolución es el rojo debido a la presencia de la forma reducida del indicador.
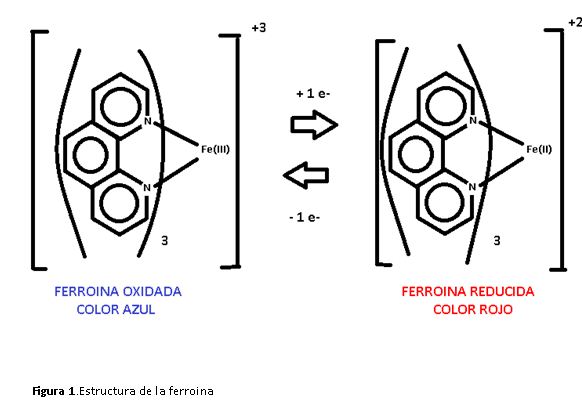
La figura 1 muestra la forma oxidada y reducida del indicador, se trata de un complejo de Fe unido a tres ligándonos bidentados fenantrolina.
Cada ligando está unido a través de los dos nitrógenos que posee, de forma que el Fe tiene un índice de coordinación 6 y una geometría octaédrica.
Se trata de un complejo muy estable, el indicador en condiciones normales es de color rojo, el metal con estado de oxidación (II).
4- Estime el periodo de las oscilaciones. ¿Las oscilaciones deben mantener su intensidad con el tiempo o deben ir amortiguándose? Para estimar el periodo de las oscilaciones de forma aproximada utilizaré las gráficas obtenidas experimentalmente.
Primero medimos el espacio de separación del eje x con una regla y seguidamente medimos una oscilación, para finalizar haciendo uso de una regla de tres obtenemos el valor de periodo.
Realizaremos este paso en las tres gráficas y para analizar la intensidad de las oscilaciones en cada caso mediremos la primera oscilación, una intermedia y la última.



Para comentar mejor los resultados prestaremos atención a la tabla siguiente.
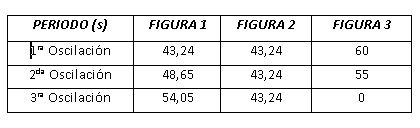
En la primera gráfica podemos ver que los valores del periodo van aumentando, es decir, a medida que avanza la reacción las oscilaciones se van amortiguando.
En la segunda gráfica el valor del periodo en las tres oscilaciones tomadas es constante, esto puede interpretarse de dos formas. El periodo no varía ya que la reacción oscila de forma constante indefinidamente o, el periodo no varía debido a que no le hemos dejado el tiempo suficiente.
Por una parte la ferroina favorece la reacción por lo que si hemos de ver como aumenta el periodo este tardará más.
Por otra parte la ferroina se adiciona una vez transcurren las dos primeras oscilaciones, si hemos de ver variaciones, estas se verán más tarde.
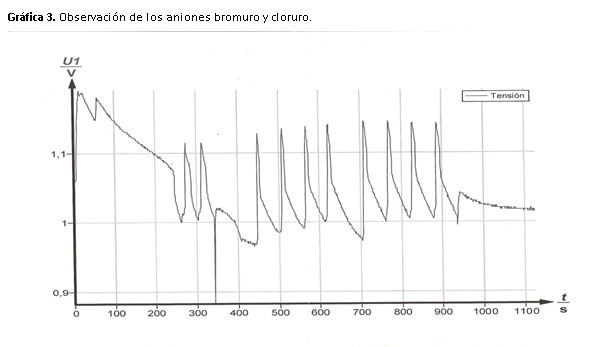
Y en la tercera gráfica el valor obtenido en la primera oscilación se debe a que al añadir KBr se genera un exceso de Br- en la reacción y las oscilaciones tardan unos segundos en restablecerse.
Cuando añadimos cloruro el periodo debe aumentar ya que estamos inhibiendo la reacción, sin embargo disminuye. Esto es debido a que el valor anterior está tomado nada más introducir el KBr, la última oscilación tiene un valor de periodo nulo ya que el inhibidor ha reaccionado con el reactante hasta detener las oscilaciones.
En resumen, las oscilaciones van amortiguándose a medida que la reacción transcurre.
5- ¿La ferroina interviene en la reacción?
La ferroina es un indicador redox [Fe(o-phen)3] +2 ó [Fe(o-fen)3]+3 dependiendo del estado de oxidación del hierro, como tal, nos permite percibir la variación de concentración y de potencial con respecto al tiempo de forma visual.
No debe intervenir en la reacción, además se adicionan en pequeñas cantidades de forma que no modifique los resultados.
Experimentalmente observamos que el intervalo de potencial en el cual la reacción oscila se ha incrementado, lo que nos señala que sí interviene de alguna forma.
Es importante comentar que la ferroina no actúa en la reacción oscilante como indicador de la variación de la concentración de Ce(III) y Ce(IV) , si así ocurriera se daría la siguiente reacción:
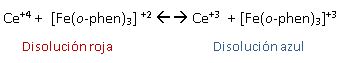
Por lo que veríamos experimentalmente que en el valor máximo de potencial la disolución sería de color rojo mientras que en el mínimo, la disolución tendría color azul.
Esto no es lo que se observa debido a que la ferroina reacciona igual que el cerio, es decir, sí que interviene en la reacción.
Es por eso que experimentalmente se observa que en el valor máximo de potencial, la disolución es azul (Ce(IV) y [Fe(o-phen)3]+3) mientras que en el mínimo, es roja (Ce(III) y [Fe(o-phen)3]+2).
6- ¿Qué sucede al añadir KBr a la disolución?¿Por qué?
Experimentalmente y estudiando la gráfica obtenida en el cuarto apartado práctico podemos observar una caída del potencial en el momento de la adición.
A medida que el tiempo pasa la reacción vuelve a oscilar de forma regular.
Analizando la reacción global siguiente.
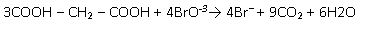
Podemos justificar el efecto producido por la adición de KBr con el principio de Le Chatelier.
Al añadir un exceso de bromuro, la reacción evolucionara de forma que disminuya el bromuro.
La reacción se desplazará a la izquierda donde el valor de potencial es máximo y la disolución es azul de esta forma, se compensará el efecto perturbador producido por el exceso de concentración de bromuro.
7- ¿Qué condiciones son necesarias para que se dé una reacción oscilante?
Las reacciones oscilantes se describen a través de mecanismos muy complejos, para que sean posibles, es necesario que la reacción se encuentre lejos del equilibrio. De esa forma en ningún momento la concentración de las especies que intervengan será constante, logrando así que sean oscilantes con el tiempo. También es necesaria la existencia de una o más etapas catalíticas, uno de los productos es el reactivo de esa misma reacción.
8- En 1970 en la Universidad de Oregón, Field, Körös y Noyes formularon un modelo cinético que explicaba las oscilaciones observadas en la reacción de BZ. Este se conoce como mecanismo FKN, una versión simplificada del cual es el Oregonator. Analice la evolución con el tiempo las especies intermedias X, Y, Z que aparecen en este modelo en diferentes condiciones haciendo uso del programa Mathematica para resolver las ecuaciones diferenciales (programa Oregonator.n).
b) Modifique las concentraciones iniciales, la [H+] y los valores de las constantes.
Serie 1: La primera serie corresponde con los valores iniciales que tiene el programa, hemos seguido los pasos del apéndice 3 para la obtención de las gráficas siguientes.
Vamos a tomar los datos y gráficas de esta serie como punto de partida luego, modificamos alguno de los parámetros y analizamos los efectos que producen en las oscilaciones de forma visual.
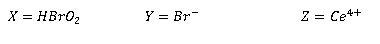
La gráfica 1 representa la concentración del ácido bromoso, de los aniones bromuro y de cerio en estado de oxidación IV. Como podemos observar hay una gran diferencia en las oscilaciones de la concentración de cerio comparada con X e Y, todas ellas representadas en función del tiempo.
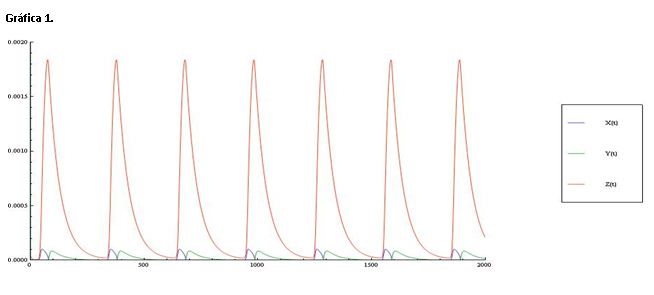
La gráfica 2 nos muestra la misma imagen anterior pero ampliada de forma que podamos ver más claramente las oscilaciones de la concentración de X e Y.
Las oscilaciones de X e Y con respecto a el tiempo son similares.
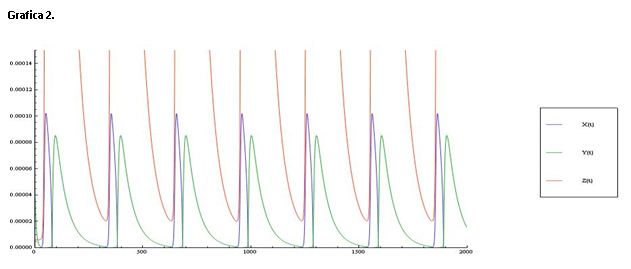
La gráfica 3 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-].
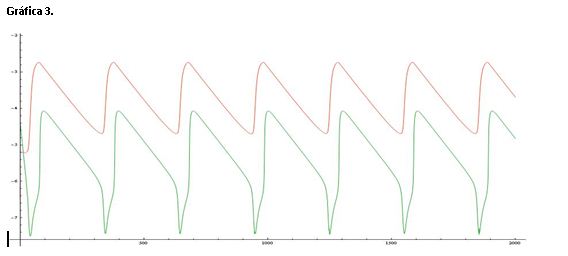
Serie 2: Modificamos la concentración de A, inicialmente tenía un valor de 0,06 M y la concentración final es 1 M.
El resto de parámetros los mantenemos constantes.
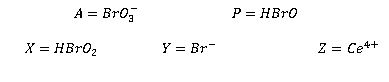
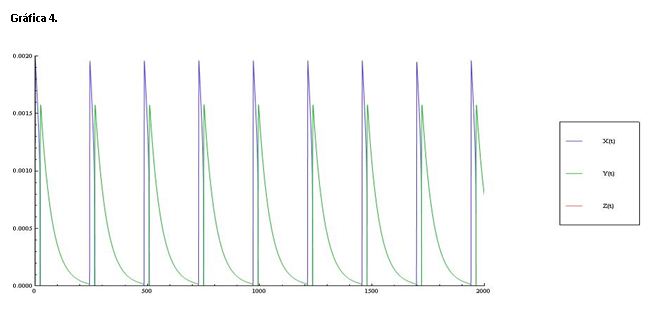
La gráfica 4 muestra las variaciones de la concentración de X e Y, Z también aparece pero se ha disparado. Z representa la concentración de Ce(IV) y cuando aumentamos A la reacción se desplaza a la derecha, es decir, esta perturbación hace que la concentración de cerio (IV) se dispare.
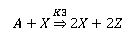
Reacción global de la segunda etapa de la reacción de BZ.
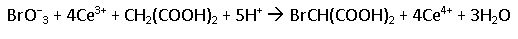
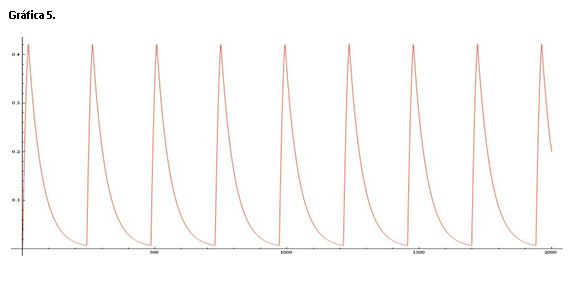
En la gráfica 5 aparecen las concentraciones de X, Y y Z aunque solo se ven las oscilaciones de Z debido a que loa concentración es muy superior a las demás y se sale de escala.
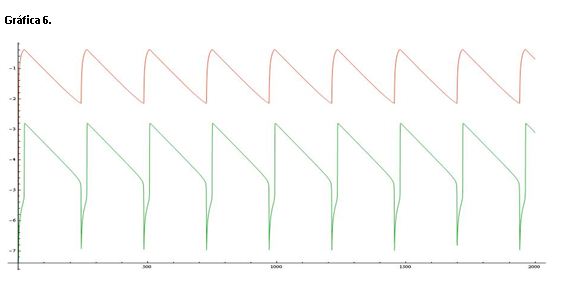
La gráfica 6 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-].
Si comparamos esta gráfica con la de referencia (serie 1) vemos que la diferencia entre ambos valores es mucho mayor, las oscilaciones de la línea verde son altas, se producen en un mayor intervalo de valores.
Serie 3: Modificamos la concentración de B de 0,02 M a 1M, B es el ácido malónico un reactante.
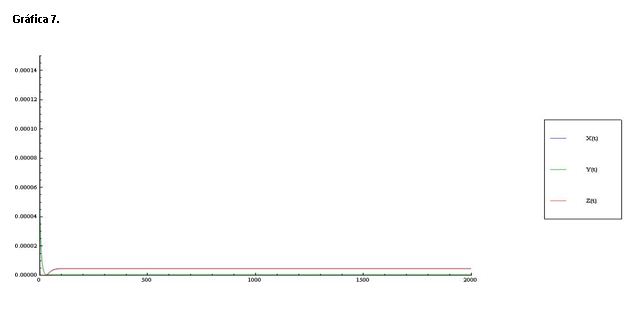
Si se observa la gráfica 7 cuando la concentración de B aumenta, desaparecen por completo las oscilaciones en la concentración de X e Y. Deja de darse la variación en la concentración de Z ya que esta el lineal.
Lo que sucede es que al aumentar la concentración de ácido este reacciona con Z e Y en la primera y segunda etapa del mecanismo.
La gráfica 8 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-].
Si comparamos esta gráfica con la de referencia (serie 1) vemos que la diferencia entre ambos valores es mucho mayor, las oscilaciones son más estrechas y picudas en ambos casos.
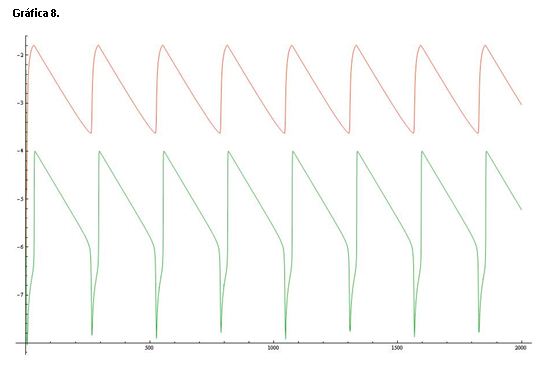
La adición de un exceso de ácido malónico inhibe el proceso oscilatorio ya que modifica principalmente la concentración de bromuro (Y) afectando a la etapa de autocatálisis.
Serie 4: En esta serie variaremos el pH del medio, modificando la concentración de protones de 0,8 M a 2.5 M.
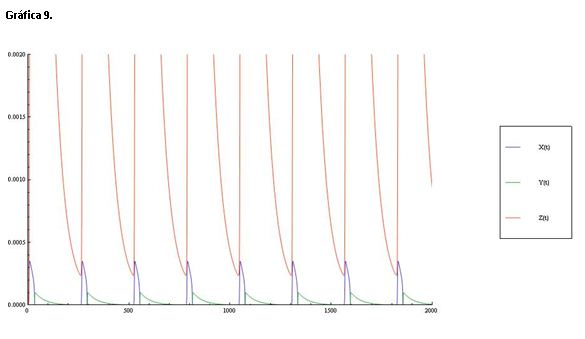
Observamos en la gráfica 9 que al aumentar notablemente el pH, las oscilaciones de Ce(IV) alcanzan concentraciones muy superiores a las de HBrO2 y Br-.
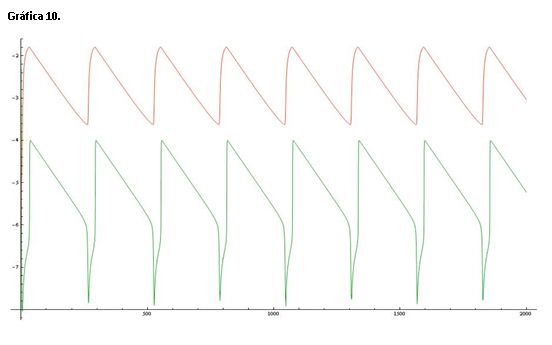
La gráfica 10 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-].
Si comparamos esta gráfica con la de referencia (serie 1) vemos que se asemejan mucho más la oscilaciones que en la serie anterior.
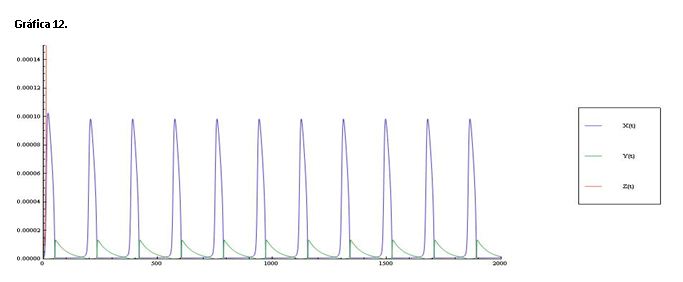
Serie 5: Modificamos la constante k1=16.0*H^2, los resultados obtenidos son análogos a los obtenidos al variar el pH. La única diferencia es que las oscilaciones de Ce(IV) alcanzan concentraciones muy superiores a las de HBrO2 y Br- incluso más que en la serie anterior.

Si ampliamos la gráfica anterior podemos ver las oscilaciones de X e Y con mayor claridad.
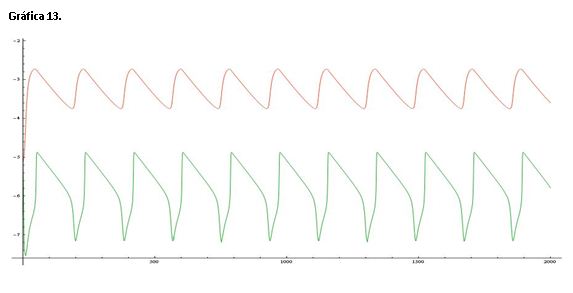
La gráfica 13 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-].
Si comparamos esta gráfica con la de referencia (serie 1) vemos que se las oscilaciones se producen con mucha rapidez, esto se debe a que aumenta la concentración de catalizador lo que acelera las oscilaciones.
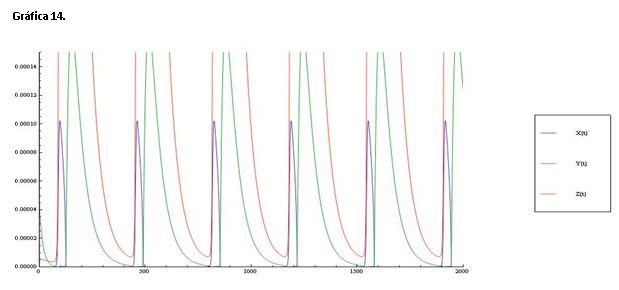
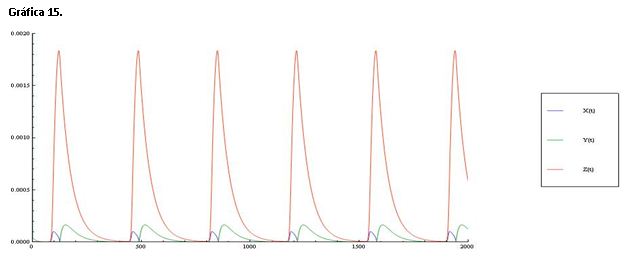
Serie 6: Modificamos la constante k1=2.0*H^6 haciendo la reacción de orden 6 para la concentración de protones. Como podemos ver en la gráfica 14 y 15 esta modificación que las oscilaciones de X, Y y Z sean muy similares
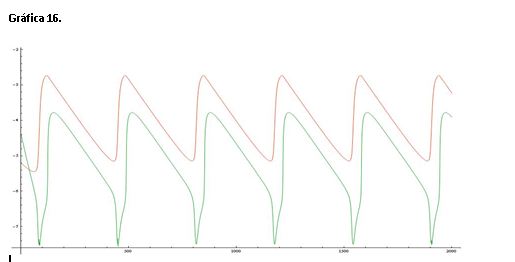
La gráfica 16 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-].
Si comparamos esta gráfica con la de referencia (serie 1) vemos que una línea está casi sobre la otra y las oscilaciones se producen en menor medida.
Serie 7: Modificamos la constante k4=500
En la gráfica 17 podemos apreciar cómo una vez más las oscilaciones de Ce(IV) alcanzan concentraciones muy superiores a las de HBrO2 y Br-. Sin embargo, esta vez las oscilaciones Br- son idénticas en máximos de concentración a las del HBrO2. Aunque las oscilaciones del HBrO2 siguen teniendo forma estrecha, alargada y picuda, mientras que las del Br- son más anchas y asimétricas.
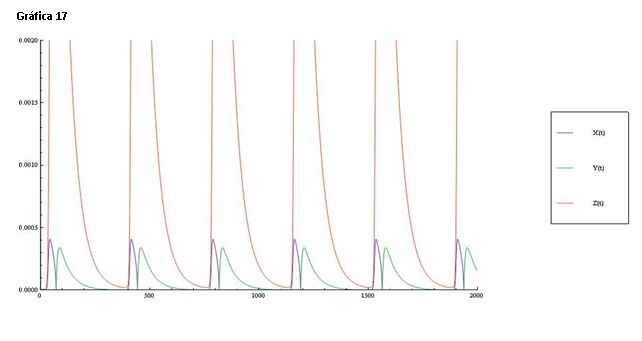
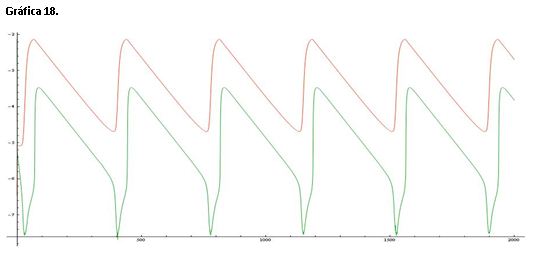
La gráfica 18 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-]. Si comparamos esta gráfica con la de referencia (serie 1) vemos que una línea está casi sobre la otra y las oscilaciones se producen en menor medida. La velocidad de las oscilaciones es menor ya que se produce una variación mucho más lenta.
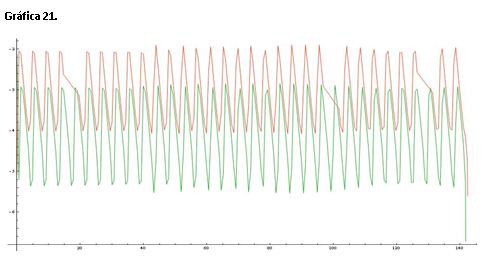
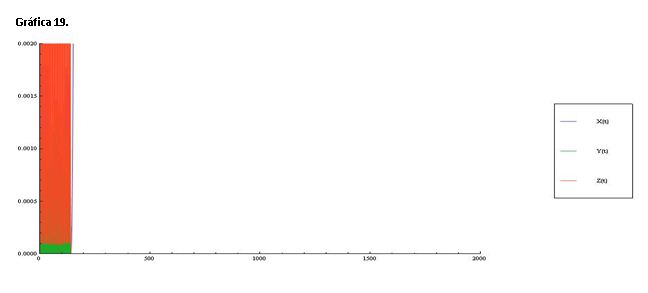
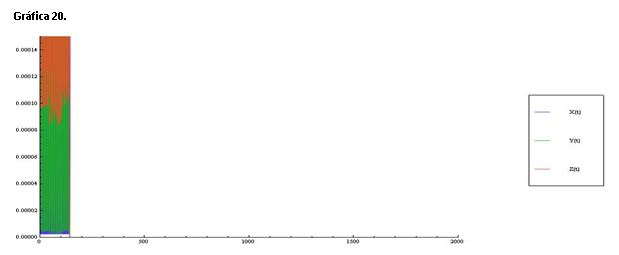
Serie 8: Modificamos las concentraciones de A=1.5 y B=2.0, hemos aumentado la concentración de los reactivos y esto provoca que las oscilaciones se den rapidísimamente dando una forma de barra en las gráficas 19 y 20.
La gráfica 21 muestra una línea de color roja que representa el log([Ce(IV)]/[Ce(III)]) y una línea verde que corresponde al log[Br-]. Una de las consecuencias de la velocidad en la que se den las oscilaciones es que los picos se muestren casi lineales y muy estrechos.