Procedimiento Experimental

Las tres últimas disoluciones las prepararemos pesando la cantidad de masa calculada, disolvemos con la disolución de ácido sulfúrico.
Una vez disuelto trasvasamos en un matraz cada disolución en el que le corresponda y enrasamos con la disolución de sulfúrico.
1- Observación de las figuras espaciales
Mezclamos en un vaso de precipitados 5 ml de KBrO3 y 5 ml de ácido malónico a partir de las disoluciones preparadas previamente.
Añadimos a la disolución 6 gotas de ferroina, esta se vuelve de color azul.
Trasvasamos la disolución a una placa de Petri y la situamos en un lugar que esté ausente de movimiento.
Seguidamente, añadimos un total de nueve gotas de disolución de Ce(IV) en tres puntos de la placa lo más separado posible el uno del otro y esperamos 15 minutos.
Agitamos la disolución, y dejamos que transcurra el tiempo necesario para que los cambio se empiecen producir, es mejor colocar un folio blanco debajo de la placa para que se aprecien mejor.

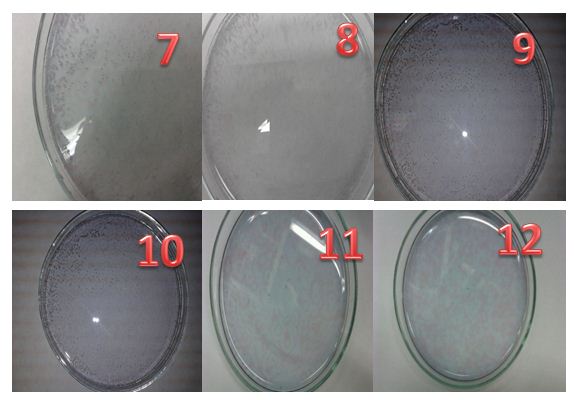 Las fotografías 1, 2, 3, y 4 muestran la mezcla de reacción, de color azul debido al indicador
Las fotografías 1, 2, 3, y 4 muestran la mezcla de reacción, de color azul debido al indicador
([Fe(o-phen)3]+3) en el momento de la adición de Ce(IV).
En la fotografía 5 se empiezan a observar la aparición de burbujas alrededor de las gotas de cerio estas se forman debido a que la reacción genera CO2 gas.
Las fotografías 6,7 y 8 muestran la disolución cuando homogeneizamos la mezcla, 15 minutos después de la adición de Ce(IV). Como podemos apreciar en las imágenes el desprendimiento de CO2 continúa produciéndose.
Las figuras espaciales aparecen aproximadamente 10 minutos después de haber homogeneizado, en las fotografías 9, 10, 11 y 12 se empiezan a exhibir espirales de color azul en un medio rojo con un espaciado uniforme.
Este fenómeno es consecuencia la reacción oscilante genera un gradiente químico debido a la variación de concentración de las especies intermedias.
La difusión de las especies hace que las figuras espaciales se propaguen por todo el sistema en forma de círculos o semicírculos que se desplazan con rapidez a no ser que la propagación se bloquee con las paredes de la placa. Cuando un espiral se encuentra con otro se cancelan.
2- OBSERVACIÓN DE LAS OSCILACIONES TEMPORALES DE LA CONCENTRACIÓN DE Ce(III) Y Ce(IV)
En un matraz de fondo redondo con tres bocas introducimos 15ml de ácido malónico y 10 ml de KBrO3 además de un imán.
Conectamos el ordenador y el potenciómetro siguiendo las instrucciones, lavamos los electrodos con agua desionizada ya que en agua contiene cloruros que pueden inhibir la reacción y los colocamos en las bocas del matraz.
Antes de empezar con las medidas encendemos la agitación para asegurarnos que el imán no golpea ningún electrodo.
Nos aseguramos que los electrodos están conectados al potenciómetro, preparamos el ordenador para iniciar la medida y pipeteamos 1 ml de disolución de Ce (IV), una vez se inicia la medida adicionamos el mililitro rápidamente.

En esta experiencia estamos midiendo el potencial en función del tiempo utilizando un electrodo de referencia de Ag|AgCl|KCl (3M) cuyo potencial es conocido y constante frente a un electrodo de trabajo (Pt), cuya respuesta va a depender del analito.
Seguiremos el potencial durante 20 minutos, una vez transcurra el tiempo imprimimos la gráfica.
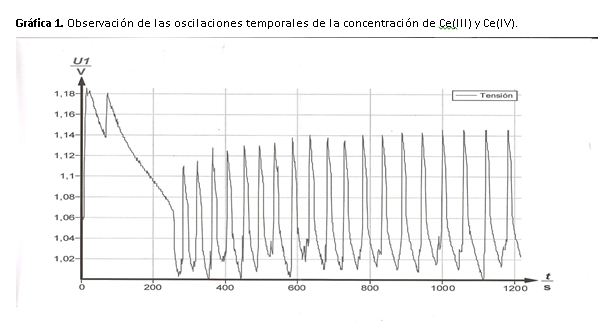
La disolución oscila de amarillo a incoloro, en el máximo de potencial (1,14 V) la disolución es amarilla y en el mínimo (1,02 V) incolora.
Cuando la disolución es amarilla nos indica que la concentración de Ce(IV) es elevada, mientras que cuando es incolora indica que la concentración de Ce(III) es mayor.
Si nos fijamos en la gráfica 1, atendiendo a la forma de los picos podemos ver que los cambios de incoloro a amarillo son casi lineales debido a que son cambios rápidos, mientras que de amarillo a incoloro se produce un cambio lento y gradual.
3- OBSERVACIÓN DE LAS OSCILACIONES EN LA CONCENTRACIÓN DE Ce(III) Y Ce(IV) EN PRESENCIA DE FERROÍNA
En un matraz de fondo redondo con tres bocas introducimos 15ml de ácido malónico y 10 ml de KBrO3 además de un imán.
Conectamos el ordenador y el potenciómetro siguiendo las instrucciones, lavamos los electrodos con agua desionizada ya que en agua contiene cloruros que pueden inhibir la reacción y los colocamos en las bocas del matraz.
Antes de empezar con las medidas encendemos la agitación para asegurarnos que el imán no golpea ningún electrodo.
Nos aseguramos que los electrodos están conectados al potenciómetro, preparamos el ordenador para iniciar la medida y pipeteamos 1 ml de disolución de Ce (IV), una vez se inicia la medida adicionamos el mililitro rápidamente.
Para la toma de medidas utilizaremos el mismo potenciómetro que en el proceso experimental anterior. En el momento en el que el periodo de inducción pase, esperamos que se observen los dos primeros ciclos y añadimos en el matraz 10 gotas de ferroína. Seguimos el potencial durante 20 minutos, una vez transcurra el tiempo imprimimos la gráfica.
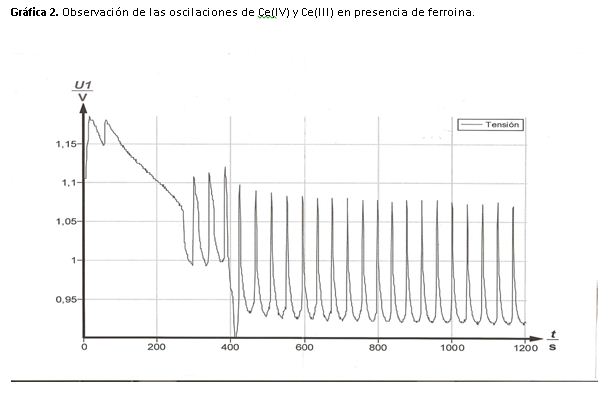
Cuando se adiciona el indicador redox, el color de la disolución oscila de azul a rojo, en el máximo (1,09 V) la disolución es azul, lo que pone de manifiesto que la ferroina está oxidada.
En el mínimo (0,94 V) la disolución es roja, esto nos indica que la ferroina está reducida.
Durante la práctica observamos que la disolución cambia de rojo a azul y esta permanece muy poco tiempo ya que una vez adquiere el color, se va produciendo un cambio gradual a rojo pasando por una serie de colores morados o granates no muy definidos.
Todos estos cambios visuales se pueden interpretar también a través de la gráfica como en el caso anterior. Los picos son finos y la subida de potencia es casi lineal debido a que la reacción es más rápida, en los máximos la concentración de Ce(IV) y ferritina (Fe+3) es elevada el color que vemos es el del indicador (azul).
Para alcanzar el mínimo el cambio es más lento, la concentración que predomina es Ce(III) y ferroina (Fe+2) el color de la disolución es el rojo debido a la presencia de la forma reducida del indicador.
4- OBSERVACIÓN DEL EFECTO DE LOS ANIONES CLORURO Y BROMURO
En un matraz de fondo redondo con tres bocas introducimos 15ml de ácido malónico y 10 ml de KBrO3 además de un imán.
Conectamos el ordenador y el potenciómetro siguiendo las instrucciones, lavamos los electrodos con agua desionizada ya que en agua contiene cloruros que pueden inhibir la reacción y los colocamos en las bocas del matraz.
Antes de empezar con las medidas encendemos la agitación para asegurarnos que el imán no golpea ningún electrodo.
Nos aseguramos que los electrodos están conectados al potenciómetro, preparamos el ordenador para iniciar la medida y pipeteamos 1 ml de disolución de Ce (IV), una vez se inicia la medida adicionamos el mililitro rápidamente.
Para la toma de medidas utilizaremos el mismo potenciómetro que en el proceso experimental anterior. En el momento en el que el periodo de inducción pase, esperamos que se observen los dos primeros ciclos y añadimos en el matraz un poco de la disolución de KBr.
Seguimos el potencial anotando los cambios, una vez la reacción vuelve a oscilar de forma normal, añadimos un poco de NaCl. Una vez transcurra aproximadamente 20 minutos desde el inicio de las medidas imprimimos la gráfica.
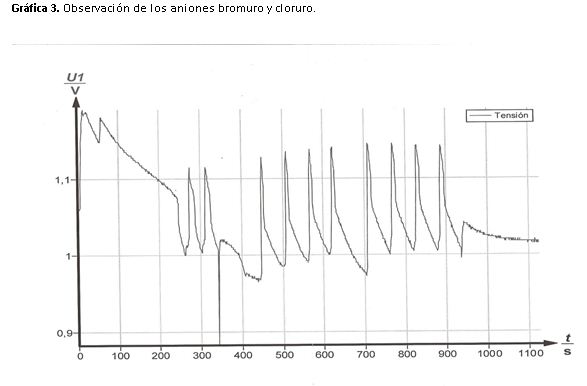
Experimentalmente y estudiando la gráfica obtenida podemos observar una caída del potencial en el momento de la adición. A medida que el tiempo pasa la reacción vuelve a oscilar de forma regular.
Podemos justificar el efecto producido por la adición de KBr con el principio de Le Chatelier.
Al añadir un exceso de bromuro, la reacción evolucionara de forma que disminuya el bromuro.
La reacción se desplazará a la izquierda donde el valor de potencial es máximo y la disolución es azul, de esta forma se compensará el efecto perturbador producido por el exceso de concentración de bromuro.
Tras la adición de NaCl observamos que las oscilaciones se van amortiguando hasta que dejan de verse. Esto se debe a que el cloro puede actuar como inhibidor de la reacción.
Reacciona fácilmente con el ácido malónico, esto provoca que la reacción se detenga debido a que se consume uno de los reactantes.
Las oscilaciones se detienen y la evolución del potencial con respecto al tiempo es lineal, debido a que el potencial es constante.