I. Introducción al procedimiento teórico
Acontinuación estudiaremos los aspectos teóricos de la reacción de BZ, primero hablaremos brevemente de los aspectos históricos de la misma. Seguidamente explicaremos los aspectos cinéticos de la reacción además del modelo químico-matemático propuesto por Noyes, Field y Körös denominado Oregonator. Para finalizar trataremos las distintas etapas de la reacción de BZ.
II. Historia

Boris Paulovich Belousov (1893-1978) es conocido por el descubrimiento de las reacciones oscilantes. Belousov observó (1959) la aparición de oscilaciones periódicas en el tiempo de la concentración de los iones Ce3+ y Ce4+ cuando estudiaba la oxidación del ácido cítrico con BrO−3 catalizada por este par redox en medio sulfúrico.
Esta reacción se conoce con el nombre de Belousove-Zhabotinskii (BZ) por la contribución de A.M.Zhabotinskii que observó (1964) el mismo tipo de oscilaciones cuando se cambiaba el ácido cítrico por malónico, o se catalizaba la reacción con otros pares redox como por ejemplo Mn2+/Mn3+ o ferroína/ferritína.
Belousov propuso un mecanismo provisional que describía la oxidación del ácido cítrico con bromato utilizando cerio como catalizador. Este fue rechazado debido a que no explicaba la complejidad del fenómeno, en 1959 finalmente logró la publicación de un breve resumen emitido por el Instituto donde trabajaba como jefe de un laboratorio (Instituto de Biofísica en el Ministerio de Salud Pública Salud). Zhabotinskii que observó en el año 1964 el mismo tipo de oscilaciones cuando se cambiaba el ácido cítrico por malónico además, introdujo el fenómeno de difusión que se producía en la mezcla de reactivos estática.
Finalmente Noyes, Field y Körös explicaron en 1972 el origen de las oscilaciones tanto de las concentraciones Ce3+/Ce4+ y de ion Br− mediante un mecanismo de reacción muy complejo conocido con el nombre de FKN.
III.Reacciones Oscilantes

Las reacciones oscilantes se describen a través de mecanismos muy complejos, para que estas sean posibles, es necesario que la reacción se encuentre lejos del equilibrio. De esa forma en ningún momento la concentración de las especies que intervengan será constante, logrando así que sean oscilantes con el tiempo. También es necesaria la existencia de una o más etapas catalíticas, uno de los productos es el reactivo de esa misma reacción.
Generalmente cualquier reacción química tiende a su posición de equilibrio más o menos rápida dependiendo del tipo de cinética que describa la reacción. La reacción no puede ir más a allá del punto de equilibrio ya que incumpliría el segundo principio de la Termodinámica.
Es por ello que para que sea posible las reacciones oscilatorias debemos tener un proceso donde todas las etapas sean irreversibles unidireccionales y se de en sistemas abiertos flujo continuo (autocatálisis). El mecanismo exacto no se llegó a conocer hasta que en 1972 Noyes, Field y Körös explicaron el origen de las oscilaciones tanto de las concentraciones Ce3+/Ce4+ y de ion Br− mediante un mecanismo de reacción muy complejo conocido con el nombre de FKN.
Se trata de un mecanismo genérico donde A y B son reactivos, X, Y e Z son especies intermedias de la reacción y P son los productos.

El Oregonator describe un mecanismo que consta de 18 etapas elementales y 21 especies químicas distintas, y nos permite explicar los aspectos más destacados del mecanismo BZ.
X es la especie autocatalítica y está presente en varias etapas por lo que va a ser una variable importante en el proceso oscilatorio.
Existen dos casos limite que van a depender de la concentración de Y, los llamáramos mecanismo I si la concentración de Y es elevada y mecanismo II si la concentración de Y es baja.
MECANISMO I: La concentración de X está es condiciones estacionarias, es decir se mantiene constante en todo momento. Y se consume, y su valor decae hasta un nivel mínimo.
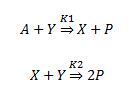
MECANISMO II: La concentración de Y se regenera hasta que alcanza un valor máximo.
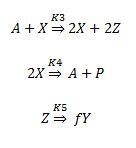
Las especies del Oregonator se corresponden con las especies en la reacción de BZ siguientes.
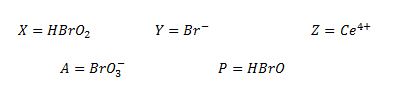
IV. REACCIÓN DE BELOUSOV-ZHABOTINSKI

El mecanismo de la reacción BZ es muy complejo, se puede simplificar separándolo en tres etapas.
Primera Etapa
La primera etapa se caracteriza por la reducción del BrO−3 a Br2 que reacciona con el ácido malónico actuando como agente bromante.
Esta primera etapa sucede en varios pasos.
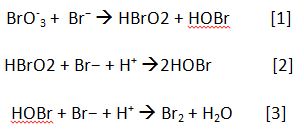
El bromo creado reacciona con el ácido malónico.

Como se observa en las reacciones el par redox Ce(III)/Ce(IV) ni interviene en esta primera etapa, se necesita un exceso de bromuro.
La reacción global vista como la suma de las cuatro reacciones citadas antes es la siguiente:
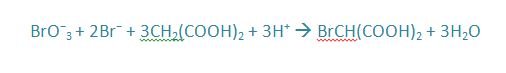
Segunda Etapa
En una segunda etapa HBrO2 actúa como agente reductor del ion BrO−3, e l HOBr sustituye al Br2 ya que broma el ácido malónico. A medida que el bromuro se reduce por debajo de un valor crítico, esta segunda etapa se realiza más rápidamente.
El par redox interviene en la reacción Ce(III) se reduce a Ce(IV), en presencia de indicador se observa el viraje de la ferroína de rojo a azul.

Tercera etapa
Y una última etapa del proceso que consiste en la reducción del Ce(IV) por acción del ácido bromomalónico dando Ce(III).
Esto ocurre cuando la concentración de Ce(IV) es elevada, en este paso se produce un aumento de la concentración de bromuro lo que favorece la primera etapa. Esta etapa explica la existencia de un largo periodo de inducción. La concentración de ácido bromomalónico debe aumentar de forma que se dé la reacción [10] produciendo un exceso de bromuro.
Durante el largo periodo de inducción hasta la aparición de las primeras oscilaciones la concentración de bromuro es muy baja. En presencia del indicador ferroina el color de la disolución vira de azul a rojo.
La tercera parte del mecanismo consta de dos reacciones:
